Ⅰ. 서 론
국제연합(UN)은 2050년까지 세계 인구가 95억 명에 이를 것으로 예상했으며, 이에 따라 동물 유래 단백질의 수요가 두 배로 증가하여 지속 가능한 식량 문제에 대한 우려를 보고하였다(Henchion et al., 2017). 인구 증가와 함께 육류의 수요도 증가하며, 가축 사육 및 관리가 환경에 미치는 영향에 대한 심각성과 우려의 증가로 전통적인 육류 생산 대체 방법의 필요성이 커지고 있다(Stephens et al., 2018). 이러한 문제들의 해결을 위해 미래 단백질 자원들이 개발되고 있으며, 그 중 체외 고기(In vitro meat)는 살아있는 동물의 세포를 채취한 뒤 세포공학 기술을 이용해 증식하여 얻을 수 있는 식용 고기로 가축을 사육하지 않고 고기를 얻는 세포농업의 한 분야로, 배양육, 세포 배양육 또는 청정육이라고도 말한다(Stephens et al., 2018). 배양육은 환경, 동물복지 등에 긍정적인 영향을 줄 수 있고 식량 위기를 완화할 수 있는 중요한 미래 단백질 자원으로 주목받아 연구되고 있다(Goodwin and Shoilders, 2013). 배양육을 생산하기 위해서는 동물 세포를 원하는 조직 구조로 배양하고 배양육의 다양한 구성 요소 비율을 조정할 수 있는 3D 바이오 프린팅 기술이 중요하며, 이는 단백질, 지방, 기타 영양 성분들을 조절하고 사실적인 식육을 만들 수 있게 한다(Handral et al., 2020; Yang et al., 2024). 또한, 3D 바이오 프린팅은 다양한 재료를 정교하게 배열할 수 있는 기술을 가지고 있어 섬유질, 지방, 혈관 등의 다양한 구성 요소를 가진 실제 고기를 재현할 수 있다.
3D 바이오 프린팅은 바이오 잉크를 통해 3차원의 생물학적 구조를 제조하는데 사용되는 기술로 재생의학 및 조직공학, 기능성 식품 생산 등 다양한 분야에서 활용된다(Ozbolat et al., 2016). 배양육에서의 3D 바이오 프린팅은 구체적인 영양 성분을 조절할 수 있고, 다양한 인쇄 재료와 부산물 활용 가능, 폐기물 감소의 장점이 있다(Bedoya et al., 2022). 3D 바이오 프린팅은 바이오 잉크를 통해 지지체를 정교하게 배열하여 상대적으로 큰 크기와 복잡한 복합 구조를 가진 근육 조직을 생산할 수 있으며, 2차원 배양보다 더 정확한 생체 내 유사한 환경을 제공할 수 있다(Guan et al., 2021; Lee et al., 2024). 배양육에서 3D 바이오 프린팅의 기술이 연구되면서 세포의 삽입과 적절한 환경 유지를 위한 중요한 재료로서 바이오 잉크의 개념이 확립되었다(Veiga et al., 2021). 배양육 생산을 위해 사용되는 바이오 잉크는 자연 유래 천연재료들로, 대부분 점탄성 특성을 가지고 3D 프린터의 노즐을 통해 출력된다(Wu et al., 2024). 따라서 3D 바이오 프린팅을 위해서는 적합한 바이오 잉크를 선정하고 정확한 비율을 설정하는 것이 중요하다.
3D 바이오 프린팅의 핵심 요소인 바이오 잉크는 세포를 운반하고 구조를 지지하는 역할로 생체 적합성, 점도, 지지체의 안정성, 무독성 등이 중요하다(Li et al., 2021). 바이오 잉크는 일반적으로 하이드로겔 pre-polymer solution과 세포로 구성되며, hydrogel은 지지체의 형성을 위해 세포와 직접 접촉하고 바이오 잉크의 화학적, 물리적 특성에 기여한다(Mandrycky et al., 2016). 하이드로겔은 크게 합성 폴리머 기반 하이드로겔과 천연 폴리머 기반 hydrogel로 나눌 수 있다(Zorlutuna et al., 2013). 합성 폴리머 하이드로겔은 지지체를 안정적으로 유지할 수 있고 정확한 출력이 가능하지만 천연 폴리머 하이드로겔에 비해 가격이 비싸며, 세포의 생존 및 성장에 중요한 생체 적합성이 떨어진다는 단점이 있다(Bian, L. 2020). 반면, 천연 폴리머 하이드로겔은 기존 세포의 기질을 유사하게 모방하여 배양육 생산에 우수한 생체 적합성을 가지고 있어 세포의 운동성과 증식 및 분화에 유리하다는 장점이 있다(Carrow et al., 2015). 본 논문에서는 천연 폴리머 하이드로겔로 사용되는 육지 식물과 해양 식물 기반 바이오 잉크의 생리학적 특징과 장단점을 조사하여 3D 바이오 프린팅에 활용하고자 한다.
Ⅱ. 재료 및 방법
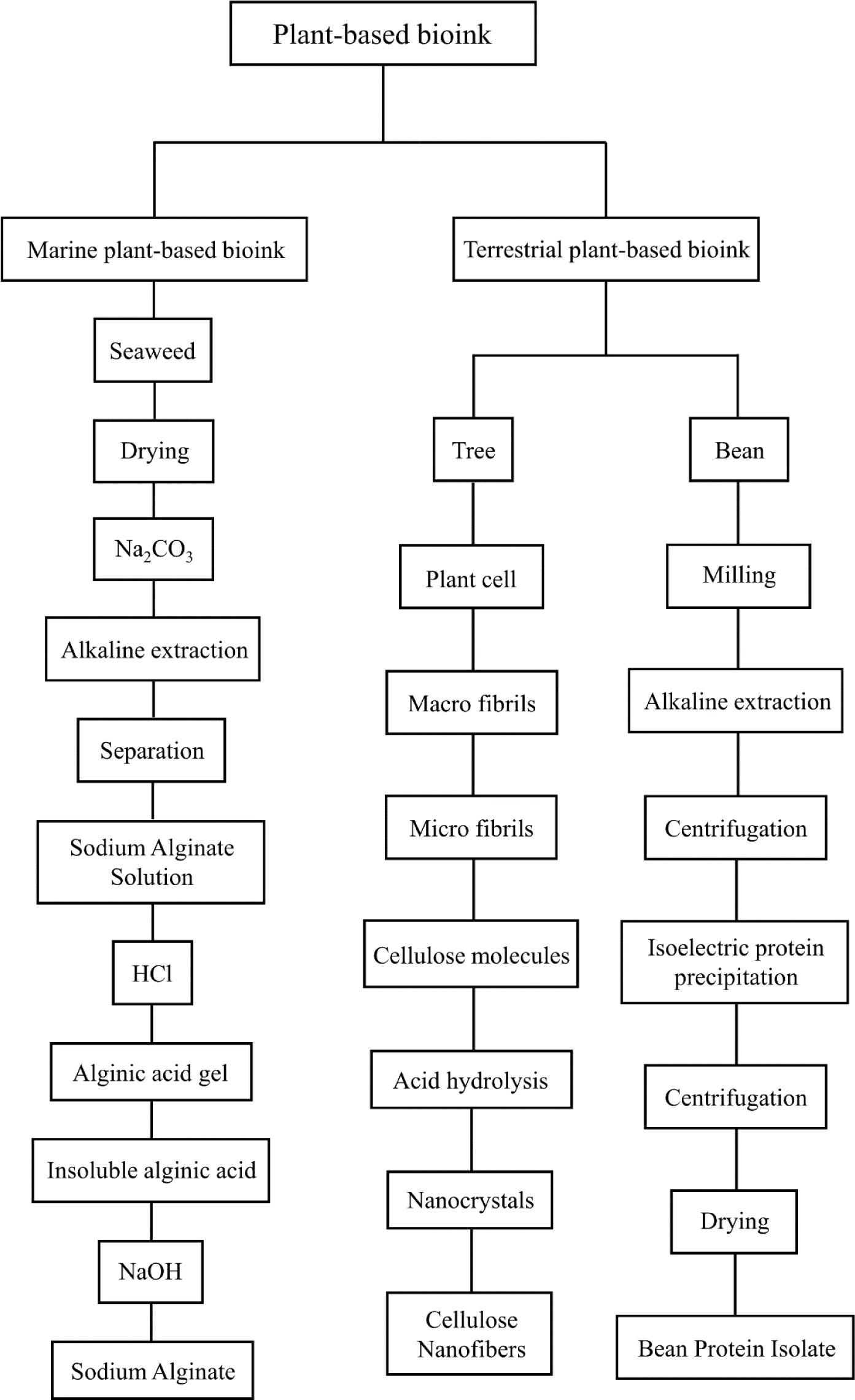
식물성 바이오 잉크는 원료 생산 과정에서 동물성 원료에 비해 적은 양의 물과 생산면적을 사용하여 자원 사용이 적으며, 저렴한 가격으로 비용 효율성을 높이고 대량 생산 시 생산비용을 절감할 수 있어 배양육 생산을 위한 식용 잉크로 많이 연구되고 있다(Soleymani et al., 2024). 대표적인 식물성 바이오 잉크 추출법을 Fig. 1에 나타내었으며, 식물성 바이오 잉크로 제조한 지지체는 세포의 성장에 중요한 친수성, 낮은 면역원성, 우수한 영양성분을 지니고 있다는 장점이 있다(Van Vliet et al., 2020). 또한, 생분해성이 뛰어나 환경에 미치는 부정적인 영향을 최소화하여 배양육 생산 후 지속 가능한 생산과 폐기물 감소에 긍정적인 효과가 있어 식물성 바이오 잉크 개발 연구가 시행되고 있다. 따라서 식물성 바이오 잉크를 활용한 지지체 개발 연구 현황을 Table 1에 나타내었다. 그러나 식물성 바이오 잉크로 제조한 배양육은 동물성 바이오 잉크를 사용한 것과는 다른 맛과 식감을 가진다는 문제점이 있다. 동물성 바이오 잉크를 이용한 배양육은 배양 후 특정 두께와 길이를 가진 성숙한 근섬유 조직과 다발로 변형되어 식육이 지닌 골격근 조직과 유사해 탄성력과 같은 기존 식육과 비슷한 식감을 지닌다는 특징이 있지만 식물성 바이오 잉크는 느슨한 섬유질 구조로 인해 탄성력이 부족하고 식물 원재료에 함유되어 있는 화합물로 인해 식감이 부족하며 쓴맛이 난다는 문제점이 있다(Wang et al., 2023). 이러한 문제를 보완하기 위해 향미 전구체인 티아민과 같은 성분을 첨가해 식육의 맛을 재현하거나 콩 단백질 조직을 열가소성 압출을 통해 물리적으로 처리하는 기술인 TSP(texturized soy protein)를 이용하여 식육과 비슷하게 식감을 개선하는 방법들이 연구되고 있다(Milani et al., 2021). 또한, 주로 다당류와 단백질로 구성되어 있는 식물성 바이오 잉크는 동물성 바이오 잉크에 비해 단순한 구조를 지니고 있어 동물성 바이오 잉크보다 분자 간 상호작용이 부족해 낮은 기계 적합성을 지니고 있으며, 출력된 지지체가 외부 힘에 의해 쉽게 변형되거나 시간이 지나면서 구조가 손상 및 약화되고 배양되는 세포의 기능에 부정적인 영향을 미칠 수 있다(Padhi et al., 2023). 이를 보완하기 위해 물리적, 화학적 등의 이중 교차결합 기술과 고분자 혼합물이 첨가된 하이브리드 바이오 잉크 개발 연구가 시행되고 있다. 따라서 현재 식물성 바이오 잉크는 저렴한 가격으로 지속 가능한 친환경적인 원료를 얻을 수 있다는 장점이 있지만, 안정적인 지지체 유지를 위한 교차결합 방법과 맛, 식감을 개선시키기 위한 추가적인 연구가 필요하다고 판단된다.
| Scaffold materials | Application | Reference |
|---|---|---|
| SPI1) | Development of cultured meat scaffolds using SPI bioink and study on cell adhesion | Mariano et al. (2024) |
| PPI2) | Cultured meat scaffolds printed with PPI bioink and differentiation of BSc cells | David et al. (2024) |
| Development of long-term stable cultured meat scaffolds using PPI bioink | Ianovici et al. (2024) | |
| SPI, PPI | Properties and cell adhesion of cultured meat scaffolds printed with PPI and SPI bioinks | Kim et al. (2024) |
| SPI, PPI, alginate | Development of cultured meat scaffolds using plant-based bioink | Ianovici et al. (2022) |
| Nanocellulose | Development of 3D printed nanocellulose scaffolds for cell culture | Rosendahl et al. (2022) |
| Nanocellulose, alginate | Study of 3D bioprinting technology using nanocellulose-alginate based bioink | Nguyen et al. (2017) |
| Study on printability of nanocellulose-alginate bioink for 3D printers | Jessop et al. (2019) | |
| 3D bioprinting of nanocellulose-alginate bioink containing cells | Ávila et al. (2016) | |
| Alginate, Type A gelatin | Development of cultured meat scaffolds using alginate and gelatin bioink | Li et al. (2021) |
| Alginate, hyaluronic acid | Study of hyaluronic acid-alginate based bioink scaffolds and 3D printing technology | Lee et al. (2021) |
| Alginate, nanocellulose, gelatin | Development of cell scaffolds using alginate based bioink | Gonzalez-Fernandez et al. (2021) |
주로 이용되는 식물성 바이오 잉크 중 셀룰로오스는 자연에 널리 분포되어 있는 천연 고분자 공급원 중 하나로, 식물 조직 세포벽의 주요 구조 요소이며 과일, 나무, 식물, 잎 및 나무껍질 등에 존재한다(Fatimi et al., 2022). 셀룰로오스를 나노미터 크기의 섬유나 결정으로 분해하여 만든 나노셀룰로오스는 나노 규모의 크기로 인해 뛰어난 기계적 강도를 가지고 있으며, 생분해성과 생체 적합성이 뛰어나고 높은 점도와 겔 형성 능력이 있어 바이오 프린팅에 사용된다(Armstrong et al., 2022). Guo 등(2023)의 배양육의 3D 바이오 프린팅에 관한 연구에 따르면, 나노셀룰로오스 기반 바이오 잉크는 세포를 적층하며 지지체 구조를 형성해 기능적인 배양육을 생산할 수 있다고 보고하였으며, 나노셀룰로오스는 생체 적합성이 우수해 배양육 생산에 적합한 재료로 평가받고 있다. 나노셀룰로오스는 바이오 프린팅 중 높은 점도를 유지하고 프린팅 후에는 안정적인 구조를 형성하는 데 중요한 역할을 하며, 이는 배양육 생산을 위한 지지체 제조 시 유용할 것이라고 판단된다(Wang et al., 2020). 그러나 나노셀룰로오스는 표면의 제타 전위가 낮기 때문에 점성이 높아지는데, 이는 노즐 기반 바이오 프린팅에서 뭉칠 가능성이 높아 노즐을 막을 수도 있을 뿐만 아니라, 잉크의 구조와 조성에 따라 세포 성장에 부정적인 영향을 미칠 수 있고 세포가 지지체의 깊은 내부까지 고르게 분포되지 않을 수 있어 지속적인 추가 연구가 필요하다(Ee et al., 2021; Han et al., 2020). 일반적으로 높은 점성을 낮추기 위해 수용성 물질과 혼합하여 바이오 잉크를 제조하는데, 나노셀룰로오스는 친수성이 강해 혼합하였을 때 인쇄가 불가능할 정도로 점성이 낮아진다는 문제점이 있으며, 이를 방지하기 위해서는 이중 교차 결합이 필요하다고 알려져 있다(Ajdary et al., 2019). 이러한 문제를 해결하기 위해 나노셀룰로오스 바이오 잉크의 농도를 세밀하게 조절하고 화학적 교차결합이 아닌 물리적 교차결합 또는 UV 경화법에 관한 연구가 진행되고 있다(Wei et al., 2021). 나노셀룰로오스 기반 바이오 잉크는 저렴한 가격으로 쉽게 구할 수 있고 점성이 뛰어나 배양육 생산 시 안정적인 지지체와 세포 부착에 유리하다는 장점이 있다. 그러나 높은 점성으로 인해 3D 바이오 프린터의 노즐 막힘 문제가 발생하여 프린팅의 연속성과 정확성을 저해할 수 있으며, 세포의 성장에 부정적인 영향을 미칠 수 있다. 따라서 나노셀룰로오스 바이오 잉크를 이용한 3D 프린팅 시 잉크의 농도와 인쇄 매개변수, 안정적인 지지체 유지를 위한 교차결합 방법에 대한 지속적인 연구와 개발이 필요하다고 판단된다(Wan Jusoh et al., 2022; Wang et al., 2020).
대두 또는 완두콩에서 분리된 콩 단백질 분리물은 가격이 저렴하고 풍부한 단백질 공급원으로 동물 유래 단백질 공급원 대체제의 기능적 및 물리화학적 특성을 가지고 있다(Ianovici et al., 2022). 식품 산업에서 콩 단백질은 기존의 식육을 모방하기 위한 물질로 많이 연구되고 있으며, 알레르기성이 낮고 영양가가 높다는 장점이 있다(Zhang et al., 2021). 배양육에서의 콩 단백질은 다양한 형태로 가공될 수 있어 세포의 부착과 성장에 도움을 주는 환경을 제공하여 생체 적합성이 높을 뿐만 아니라, 일반적으로 면역계에 의해 잘 받아들여지는 단백질로 낮은 면역원성을 지니고 있다(Singh et al., 2022). Sharma 등 (2023)의 대두 단백질 분리물을 바이오 잉크로 사용한 바이오나노복합체의 제조, 특성화 및 응용 연구에서도 분리 대두 단백질 바이오 잉크를 배양육 생산 시 이용하였을 때, 친환경적인 생분해성을 제공하며, 세포의 접착, 생존 및 성장에 적합하다고 보고하였다. 그러나 콩 단백질은 사포닌, 리폭시게나제 및 이소플라본 화합물로 인해 기존의 식육과는 다른 쓴맛과 떫은맛이 존재하기 때문에 후처리를 통한 화합물 제거가 필요하다(Rubio et al., 2020). 뿐만 아니라, 완두콩 단백질 분리물 바이오 잉크는 용해성과 보수성이 낮아 3D 바이오 프린팅 지지체의 인쇄 정밀도가 떨어진다는 문제점이 있으며, 대두 단백질 분리물 바이오 잉크 또한 지지체의 안정성을 위해 인쇄 온도, 인쇄 속도, 사출 압력 등의 인쇄 매개변수에 대한 세부적인 연구가 필요하다(Chen et al., 2024). 이러한 문제를 해결하기 위해 알지네이트 또는 젤라틴 등의 고분자 물질들과 혼합하여 기계적 강도를 보완하고 지지체의 구조적 안정성을 향상시키는 연구가 시행되고 있다(Carranza et al., 2024). Alesaeidi 등 (2023)의 조직공학을 위한 분리대두단백과 알지네이트가 혼합된 하이드로겔 개발 연구에서는 분리대두단백과 알지네이트를 혼합하였을 때 하이드로겔의 점도가 향상되어 기계적 강도를 향상시키며, 안정적인 지지체를 형성할 수 있다고 보고하였다. 완두콩과 대두 등의 콩 단백질 분리물을 이용한 식물성 바이오 잉크는 가격이 저렴하고 영양가가 풍부하며, 세포의 접착에 유리하다는 장점이 있어 대표적인 동물성 단백질 대체제로 배양육 생산을 위해 많은 연구가 이루어지고 있다. 그러나 3D 바이오 프린터의 기계 적합성을 위한 세부적인 연구가 부족하고 기존 식육의 식감과 맛을 대체하기 어려워 상업적으로 이용하기에 소비자들의 선호도가 떨어진다는 문제점이 있어 이를 해결하기 위한 추가적인 연구가 필요하다고 판단된다.
알지네이트는 갈조류 등의 해양 식물 세포의 세포벽에서 주로 추출되는 천연 해양 다당류 바이오 잉크로 비동물 유래 물질이다(Lin et al., 2022). 현재 알지네이트는 주로 조직 공학 및 뼈 재생, 상처치유 등의 재생의학에 사용되고 있으며, 생분해성, 생체적합성 등의 장점이 있다(Gao et al., 2021). 뿐만 아니라 비세포독성으로 식용 가능하고 상대적으로 저렴한 재료이기 때문에 배양육 생산 등과 같은 식품과학에서 결합제, 안정제 등으로 주로 사용된다(Lee et al., 2024). Andersen 등 (2015)의 알지네이트 하이드로겔의 3D 바이오 프린팅 세포 배양 연구에 따르면 알지네이트는 세포의 생체 적합성과 교차결합된 하이드로겔 형성 용이성의 장점이 있어 바이오 잉크로서의 적합성을 보고하였다. 또한, 젤라틴으로 안정화된 알지네이트를 사용하여 세포의 3D 바이오 프린팅에 적합한 지지체를 형성하였으며, 세포가 80% 이상 생존하여 생존율이 높다고 보고하였다(Andersen et al., 2015). 그러나 알지네이트 기반 지지체는 기계 적합성이 낮아 복잡한 구조를 프린팅하기에 적합하지 않고 지지체를 안정적으로 장시간 유지하지 못한다는 문제점이 보고되었다(Li et al., 2016). 또한, 기계 적합성이 낮으면 세포가 안정적으로 부착하고 성장할 수 있는 환경을 제공하지 못해 세포의 생존율이 낮아진다는 문제가 있다(Gao et al., 2021). Tahir와 Floreani (2022)의 배양육을 위한 알지네이트 기반 지지체의 기계적 특성 향상 연구에서는 안정적인 알지네이트 지지체를 출력하기 위해 RGD 펩타이드를 혼합한 바이오 잉크를 사용하면 인쇄성이 향상되고 세포 부착력이 높은 지지체가 안정적으로 유지된다고 보고하였으며, 이와 관련된 알지네이트 기반 혼합 바이오 잉크 지지체 연구가 지속되고 있다. 하지만 알지네이트는 불규칙적인 생분해 속도를 가지고 있어, 배양육과 같은 세포 공학에서 세포의 성장과 분화에 부정적인 영향을 미칠 수 있을 뿐 아니라 바이오 잉크의 기계적 특성과 생물학적 특성이 변화될 수 있다는 문제점이 있다(Axpe and Oyen, 2016). 따라서 알지네이트 바이오 잉크는 생체 적합성이 뛰어나고 비세포독성으로 안전하게 식용 가능하다는 장점이 있지만, 낮은 인쇄성과 지지체가 안정적으로 유지되기 어렵다는 문제점으로 인해 단독으로 사용하기 어려워 다른 혼합물이 필수적으로 첨가되어야 한다. 또한, 불규칙적인 속도의 생분해성으로 인해 이를 조절하기 위한 추가적인 연구가 필요하다고 판단된다.
Ⅲ. 결 론
배양육은 기존의 동물 유래 단백질을 대체할 대표적인 미래 단백질 자원 중 하나로 식량 위기를 대비할 수 있는 세포농업이다. 배양육 생산에 중요한 세포배양은 세포의 성장과 분화를 위해 적절한 환경이 제공되는 것이 중요하며, 이는 바이오 잉크와 밀접한 연관이 있다. 바이오 잉크의 특성에 따라 기계 적합성, 지지체의 구조적 안정성, 세포의 생체 적합성 및 영양 공급에 영향을 미친다. 바이오 잉크는 동물성, 식물성, 그 외 화합물 등 여러 종류가 있으며, 그중 해양 식물과 육지 식물로 나눌 수 있는 식물성 바이오 잉크는 높은 생분해성을 가지고 종교적 제약이 없다는 장점이 있다. 대표적인 식물성 바이오 잉크는 나노셀룰로오스, 콩 단백질 분리물, 알지네이트가 있으며, 세포의 성장에 중요한 친수성, 낮은 면역원성, 식용 가능하다는 장점으로 많이 연구되고 있다. 그러나 기계 적합성이 부족하여 안정적인 지지체를 장기적으로 유지하기 어렵다는 문제점이 있다. 이러한 문제를 해결하기 위해 인쇄 온도, 인쇄 속도, 사출 압력 등의 인쇄 매개변수에 대한 연구와 가교제 결합 등의 세부적인 연구가 진행되고 있다. 원료를 이용하여 잉크를 생산하는 과정에서 기존의 가축 사양에 비해 자원 사용이 적으며, 저렴한 가격으로 비용 효율성을 높이고 대량 생산 시 생산비용을 절감할 수 있어 배양육 시장 상업화에 유리한 식물성 바이오 잉크는 시장 확대를 위해 지속적인 연구가 필요하다고 판단된다.