ARTICLE
Chicken Serum과 Horse Serum이 닭 근육위성세포의 증식과 분화에 미치는 영향
오세혁1
,
김윤아1
,
최나영1
,
김학연2
,
최정석1,*
Effect of Chicken Serum and Horse Serum on Proliferation and Differentiation of Chicken Muscle Satellite Cells
Sehyuk Oh1
,
Yun-a Kim1
,
Nayoung Choi1
,
Hackyoun Kim2
,
Jungseok Choi1,*
Author Information & Copyright ▼
1Department of Animal Science, Chungbuk National University, Cheongju 28644, Korea
2Department of Animal Resources Science, Kongju National University, Chungnam 32439, Korea
*Corresponding author : Jungseok Choi, Department of Animal Science, Chungbuk National University, Cheongju 28644, Korea, Tel : 82-42-261-2551, E-mail :
jchoi@chungbuk.ac.kr
© Copyright 2022 Resource Science Research Institute, Kongju National University. This is an Open-Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0/) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Nov 29, 2022; Revised: Dec 08, 2022; Accepted: Dec 09, 2022
Published Online: Dec 31, 2022
Abstract
For efficient production of cultured meat, chicken breast muscle cells and chicken leg muscle cells were proliferated and differentiated using medium with various serums, and proliferation and differentiation ability were analyzed. Chicken breast muscle cells and chicken leg muscle cells were cultured with serum-free medium (NC), medium with 20% FBS (C), medium with 10% chicken serum (CS) and 5% horse serum (HS) (T1), medium with 10% CS (T2), medium with 5% HS (T3). Using the immunofluorescence staining, Pax7 and nuclei were stained in chicken breast muscle cells and chicken leg muscle cells to confirm that they were muscle satellite cells. As a result of cell counting, both cells cultured in T1 medium proliferated the most. Chicken breast muscle cells and chicken leg muscle cells were subcultured from passage 1 to passage 6 using T1 medium. In both cells, viability and number of live cells decreased with increasing passage, but chicken leg muscle cells had higher viability and number of live cells than chicken breast muscle cells in all passages. Cells were differentiated using differentiation medium containing 10% chicken serum and 5% horse serum for each passage. It was confirmed that the differentiation ability of chicken leg muscle cells was more maintained as passage increased than chicken breast muscle cells. Therefore, it is considered that the results of chicken cells will become the basic data for the development of cultured meat.
Keywords: Serum; Proliferation; Differentiation; Chicken muscle satellite cell; Cultured meat
Ⅰ. 서 론
2013년, Mosa Meat 기업으로 인해 최초의 배양 쇠고기 햄버거가 만들어진 이후, 수십 개의 기업이 닭고기, 쇠고기, 돼지고기, 해산물 등 다양한 배양육 제품을 개발하고 있다(Choudhury et al., 2020). 육류에 대한 전 세계 수요는 세계 인구가 증가함에 따라 빠르게 증가할 것으로 예상되며, 동물 고기 소비를 줄이기 위해 제안된 한 가지 해결책으로 동물의 도축 없이 동물 세포로 제조 가능한 배양육의 개발이 대두되고 있다(Post, 2012). 배양육 분야가 대두되면서 미국, 이스라엘, 네덜란드, 캐나다, 일본, 싱가포르, 스페인, 중국, 영국, 터키 등 여러 국가에서 세포기반 배양육 개발이 활발하게 진행되고 있다(Faustman et al., 2020).
가금류 고기는 전체 육류 시장에서 약 3분의 1의 점유율을 차지하고 있으며, 그 중 닭고기는 세계 육류 시장의 29% 이상을 차지하고 있다(Belova et al., 2012). 전 세계적으로 육류 소비량에서도 닭고기가 높은 기여도를 가지고 있음에도 불구하고 배양육 생산을 위한 닭 세포 연구는 미흡한 수준이다(Liu et al., 1999; Whitton et al., 2021).
근초와 기저판에서 발견되는 근육위성세포는 근육의 발달과 회복, 재생에 관여한다(Yin et al., 2013). 평상시에는 휴식 상태이지만 외부 자극에 활성화될 수 있으며, 활성화된 위성 세포는 증식을 통해 근아세포를 반복적으로 증가시킬 수 있다. 또한 분화를 통해 근아세포는 서로 부착되어 근관과 근섬유아세포를 형성할 수 있으며, 근아세포는 골격근과의 융합으로 재생 및 성장을 할 수 있다(Lim and Son, 2019; Post, 2012). 배양육 생산을 위한 다양한 세포 유형 중에서 근육 위성세포가 가장 효과적이고 유망한 것으로 나타났다(Post, 2012). 줄기세포 중에서는 근육 위성세포를 제외한 배아줄기세포, 유도만능줄기세포, 지방유래 성체줄기세포 등이 있으며 충분한 분화 능력을 가지고 있지만, 성공적인 근육 조직 형성 여부는 아직 보고되지 않았다(Kadim et al., 2015).
배양육은 환경오염, 메탄 배출, 토지와 물 부족, 육식으로 인한 동물복지 등 다양한 윤리적, 환경적, 보건적 문제를 완화할 수 있는 잠재력을 가지고 있다(Bhat et al., 2011; Bryant and Sanctorum, 2021). 배양육의 많은 장점에도 불구하고 일반적인 방법으로 생산되는 육류에 비해 생산단가가 높기 때문에 대중적인 소비가 되지 못하고 있다(Choi, 2019). 배양육의 생산단가를 낮추기 위해서는 무엇보다 배양효율을 높이는 것이 최우선이다. 세포 배양 기술을 사용하여 이상적인 조건에서 세포를 배양하면 최대 20배까지 증식하여 아주 적은 수의 세포로 많은 양의 근섬유를 얻을 수 있다(Mizuno et al., 2010). 따라서 효율적으로 배양육을 제조하기 위해 세포의 증식과 분화 시간을 단축시키기 위한 연구가 필요하다. 혈청을 보충한 배지는 세포의 생존과 증식에 필요한 성장인자, 호르몬, 지질 성분 등을 풍부하게 포함하고 있어 다양한 세포 유형에 효과적이다(Ho et al., 2021; O’Flaherty et al., 2020). 또한 혈청은 전통적인 육류 생산의 값비싼 부산물이며, 세포 배양에서 보충제로 널리 사용된다(Bhat et al., 2019; Kolkmann, 2020). 일반적으로 세포 증식 단계에서 10~20%, 분화 중에 0.5~2%로 사용된다. 배양육 생산을 위한 비용의 많은 부분이 혈청에 사용되고 있기 때문에 배양육의 생산 단가를 낮추기 위해선 혈청의 선정이 중요하다.
따라서 본 연구에서 효율적인 배양육 생산을 위해 닭가슴 근육 세포와 닭다리 근육 세포의 배양에 가장 적합한 배양 혈청을 선정하고 닭 근육 세포의 증식과 분화의 성능을 확인하여, 닭 근육 세포를 배양육 생산에 사용하기 위한 기초적인 데이터를 제공한다.
Ⅱ. 재료 및 방법
세포
직접 도축한 닭의 가슴살과 다리살의 근육조직으로부터 근육세포를 분리하여 사용하였다. 닭을 도축하는 과정은 충북대학교 동물실험윤리위원회의 승인을 받아 진행하였다(IACUC No. CBNUA-1477-20-02).
배양 배지에 첨가된 혈청
다양한 혈청에 따른 닭가슴 근육세포와 닭다리 근육세포의 증식 능력을 비교하기 위하여 혈청을 넣지 않은 배지인 Negative Control(NC), 20% FBS를 첨가한 Control(C), 10% Chicken Serum(CS; 16110082, Gibco, New Zealand)과 5% Horse Serum(HS; 26050088, Gibco, New Zealand)을 첨가한 배지(T1), 10% CS을 첨가한 배지(T2), 5% HS을 첨가한 배지(T3)를 준비하여 세포를 배양하였다(Table 1).
Table 1.
The type of serum added to the medium in experimental group and the treatment group
|
|
C (Control) |
NC (Negative control) |
T1 |
T2 |
T3 |
| FBS |
20% |
|
|
|
|
| Chicken serum |
|
|
10% |
10% |
|
| Horse serum |
|
|
5% |
|
5% |
Download Excel Table
증식 & 계대배양
세포를 증식하기 위해 콜라겐으로 코팅한 플라스크를 준비했다. 콜라겐 코팅 용액(C2124, Sigma- Aldrich)은 5 mg/mL의 콜라겐 용액을 증류수로 0.5% 농도로 희석하여 사용하였으며 콜라겐 가용화를 위해 최종 농도가 2%가 되도록 1 M 아세트산을 첨가하였다. 제조된 콜라겐 용액을 플라스크에 분주한 뒤, 37°C의 인큐베이터에서 16시간 방치하였다. 실험에 사용하기 전에 코팅 용액을 제거한 후, 플라스크를 1 × phosphate buffered saline(PBS; Cytiva HyCloneTM, UT, USA)를 사용하여 2회 세척하여 실험에 사용하였다. 세포 증식을 위한 배지(Growth Medium; GM)는 DMEM 배지(11995-065, Gibco, USA)에 1% penicillin-streptomycin-amphotericin B(PSA; 17-745E, Lonza, USA)와 실험 설계에 맞게 다양한 혈청을 첨가하여 제조하였다(Table 1). 효과적인 세포 증식 및 성장을 위해 basic fibroblast growth factor(bFGF; Gibco, USA)를 최종 농도가 0.05% 되도록 플라스크에 첨가한다. 닭가슴 근육세포와 닭다리 근육세포는 1,800 cells/cm2의 밀도로 플라스크에 분주하였으며, 37°C, 5% CO2 인큐베이터에서 6일간 배양하였다.
닭가슴 근육세포와 닭다리 근육세포의 계대배양에 따른 증식 능력을 비교하기 위해 이전의 세포 증식 실험에서 가장 성적이 좋았던 배지를 선정하여 두 세포를 배양하였다. 계대배양을 위해 플라스크 내 증식 배지를 제거한 후 트립신(25300062, Gibco, Canada)을 첨가하였다. 37°C 인큐베이터에서 3분간 방치하여 플라스크에서 세포를 떼어낸 후, PBS에 FBS를 2% 첨가하여 제조한 trypsin neutralizing solution(TNS)을 첨가하여 중화하였다. 350 × g의 속도로 5분간 원심분리하여 세포만 채취하였다.
분화
세포를 분화시키기 위해 마트리겔(354234, Corning, VA, USA)로 코팅한 플라스크를 준비했다. 마트리겔을 차가운 1 × PBS와 1:200 비율로 희석하여 마트리겔 코팅 용액을 제조하였다. 제조된 마트리겔 코팅 용액을 플라스크에 분주한 뒤, 37°C의 인큐베이터에서 4시간 방치하였다. 실험에 사용하기 전에 코팅 용액을 제거한 후, 플라스크를 1 × PBS를 사용하여 2회 세척하여 실험에 사용하였다. 닭 근육세포는 1,800 cells/cm2의 밀도로 플라스크에 분주하였으며, 앞서 서술한 증식에 사용된 배지를 이용해 37°C, 5% CO2 인큐베이터에서 6일간 배양하였다. 분화에 사용된 배지(differentiation medium; DM)는 DMEM에 2% FBS와 1% PSA를 첨가하여 제조하였다. 6일간 증식시킨 닭가슴 근육세포와 닭다리 근육세포에서 증식 배지를 제거한 후 분화 배지를 첨가하여 분화를 유도하였다.
세포 계수
세포를 트립신을 이용해 플라스크에서 때어내고 TNS를 이용해 중화하였다. 트리판 블루 용액(T8154, Sigma, UK)으로 염색한 후 cell counter(Countess® cell FL automated cell counter, Invitrogen, MA, USA)를 사용하여 세포 수를 계수하였다.
면역형광 염색
닭 근육세포를 96-well 플레이트에 1,800 cells/cm2의 밀도로 분주하고 37°C, 37°C, 5% CO2 인큐베이터에서 4일간 배양하였다. 배양액을 제거한 후 세포를 1 × BPS로 세척하고 2% 파라포름알데히드(GeneAll, Korea)로 37°C 인큐베이터에서 45분간 처리하였다. 1 × PBS로 세척한 후, 세포를 실온에서 0.1% Triton-X(Sigma-Aldrich, MO, USA)로 20분간 처리하였다. 그 후, 세포를 2% 소 혈청 알부민(Bovine Serum Albumin, BSA; Roche, IN, USA)과 함께 실온에서 30분간 방치하고, 1 × PBS로 2회 세척하였다. 이후 Paired box 7(PAX7) 항체(1:100, PA5-68506, Invitrogen)와 함께 4°C에서 밤새 반응시켰다. 1 × PBS로 2회 세척한 후, 세포를 goat anti-rabbit IgG cross-adsorbed 2차 항체(1:1000, A21121, Invitrogen)와 함께 실온에서 2시간 동안 반응시켰다. 마지막으로 Hoechst(H3570, Invitrogen)으로 2분간 반응시켰다. 닭 근육 세포의 면역형광 염색은 EVOS-5000 광학현미경을 통해 관찰하였다.
Ⅲ. 결과 및 고찰
닭 근육세포의 증식과 세포 수
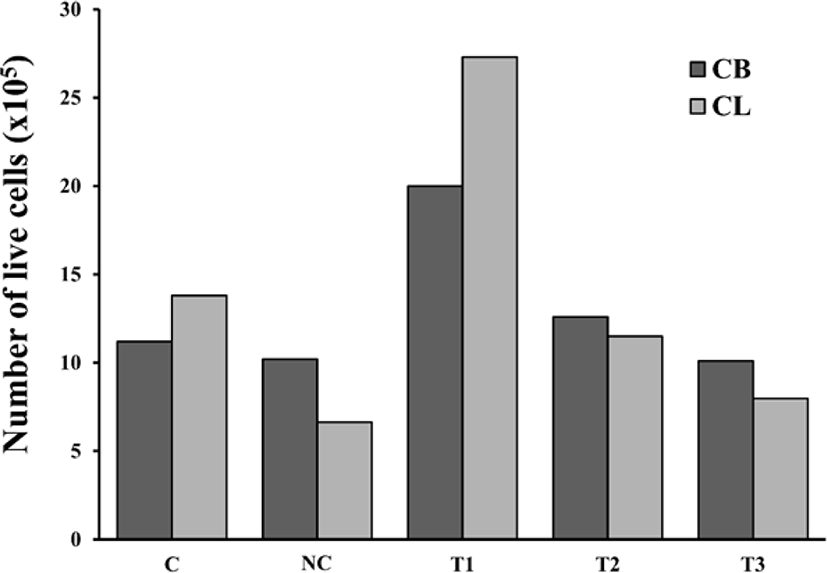
닭가슴 근육세포(Fig. 1)와 닭다리 근육세포(Fig. 2)를 37°C, 5% CO2 인큐베이터에서 다양한 혈청을 첨가한 배지로 6일간 배양하였다. 이후 Cell counter를 이용하여 살아있는 세포 수를 측정하였다 (Fig. 3). 10% tryptose phosphate broth 대신 닭 혈청을 첨가한 배지로 QM7 메추리 근육세포를 배양하였을 때, 근육 세포가 더 빠르게 성장하고 분열하였다는 연구 결과가 있으며(Choi et al., 2022), 말 혈청을 첨가한 배지가 병아리 배아세포의 증식을 크게 촉진하였다는 연구 결과도 있다(Verger, 1979). 닭가슴 근육 세포와 닭다리 근육 세포 모두 10% CS와 5% HS를 배지에 첨가한 실험구에서 가장 많은 세포를 측정할 수 있었다.
Fig. 1.
Proliferation of cultured chicken breast cells from day 1 to day 6 (40 × magnification).
(A) Control (Medium with FBS 20%), (B) Negative control (NC; medium without serum), (C) T1 (Medium with chicken serum 10%, horse serum 5%), (D) T2 (Medium with chicken serum 10%), (E) T3 (Medium with horse serum 5%).
Download Original Figure
Fig. 2.
Proliferation of cultured chicken leg cells from day 1 to day 6 (40 × magnification).
(A) Control (Medium with FBS 20%), (B) Negative control (NC; medium without serum), (C) T1 (Medium with chicken serum 10%, horse serum 5%), (D) T2 (Medium with chicken serum 10%), (E) T3 (Medium with horse serum 5%).
Download Original Figure
Fig. 3.
Cell counting of chicken breast (CB) muscle cells and chicken leg (CL) muscle cells cultured for 6 days.
C (Control; Medium with FBS 20%), NC (Negative control; Medium without serum), T1 (Medium with chicken serum 10%, horse serum 5%), T2 (Medium with chicken serum 10%), T3 (Medium with horse serum 5%).
Download Original Figure
면역형광 염색
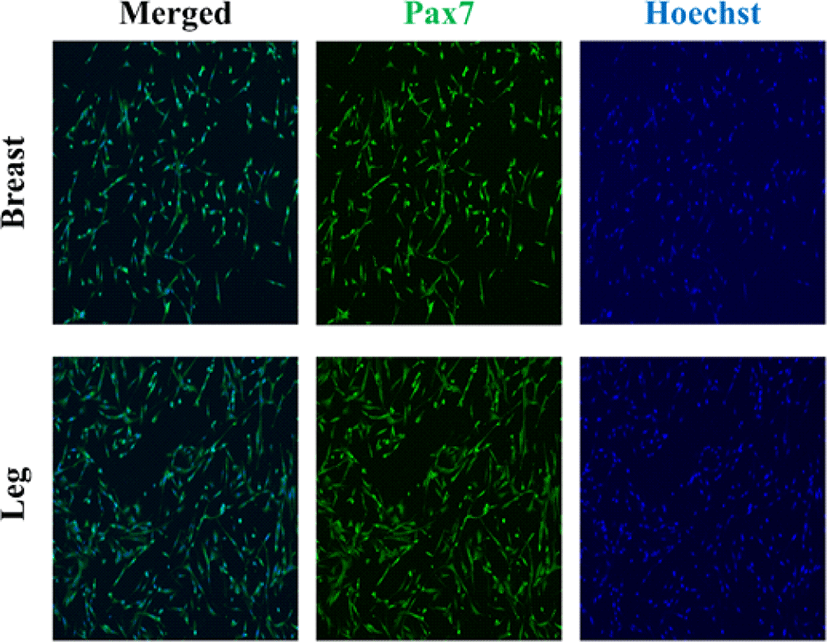
배양된 닭가슴 근육세포와 닭다리 근육세포를 Pax7 항체와 Hoechst를 사용하여 면역형광 염색을 하였다(Fig. 4). Pax7은 위성세포 유래 근아세포에서 특이적으로 발현되는 유전자로, 근육의 위성세포에서도 발현된다(Leale et al., 2000). Hoechst 염료는 세포의 DNA를 염색하여 핵을 확인하는데 사용되는 가장 인기 있는 형광체이다(Bucevičius et al., 2018). Hoechst 염색을 통해 세포의 DNA를 염색해 핵을 관찰하였고, Pax7 염색을 통해 근육 위성세포임을 확인하였다.
Fig. 4.
Representative immunofluorescence microscopy image of the nuclei and pax7 of satellite cell from chicken breast muscle cells and chicken leg muscle cells after confluent of proliferation on day 6 (100 × magnification).
Download Original Figure
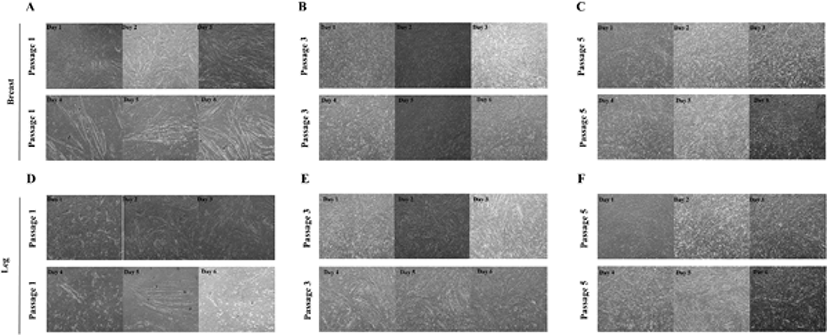
닭 근육세포의 계대배양
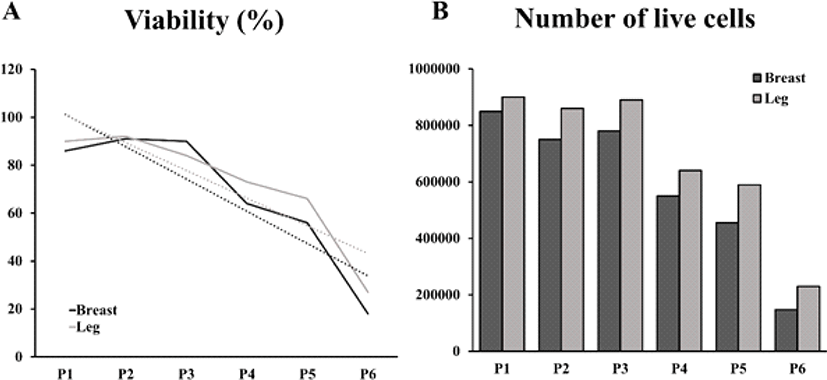
닭가슴 근육세포와 닭다리 근육세포를 Passage 1부터 Passage 6까지 계대배양하면서(Fig. 5) 세포의 생존율과 살아있는 세포의 수를 측정하였다(Fig. 6). 앞선 실험에서 증식 능력 성적이 좋았던 10% CS와 5% HS를 첨가한 배지를 선정하여 계대배양에 따른 증식 능력을 확인하기 위한 배지로 사용하었다. 실험 결과, 계대배양을 진행할수록 세포의 생존율과 살아있는 세포의 수가 지속적으로 감소되는 것을 확인하였다. 모든 passage에서 닭다리 근육세포의 생존율과 살아있는 세포의 수가 닭가슴 근육세포보다 높게 나타났다.
Fig. 5.
Proliferation of cultured chicken breast muscle cells and chicken leg breast muscle cells from day 1 to day 6 (40 × magnification).
(A), (B), (C) Microscopy images showing the proliferation of chicken breast muscle cells from day 1 to day 6 from passage 1, 3, 5. (D), (E), (F) Microscopy images showing the proliferation of chicken leg muscle cells from day 1 to day 6 from passage 1, 3, 5.
Download Original Figure
Fig. 6.
Viability and cell counting of chicken muscle cells from passage 1 to passage 6.
(A) Graph of viability of chicken breast muscle cells and chicken leg muscle cells from passage 1 to passage 6. (B) Number of live cells of chicken breast muscle cells and chicken leg muscle cells from passage 1 to passage 6.
Download Original Figure
닭 근육세포의 분화
닭가슴 근육세포와 닭다리 근육세포를 분화 배지를 이용하여 6일동안 분화하였다(Fig. 7). 계대배양을 진행할수록 세포의 분화능력이 떨어져 분화가 이루어지지 않는 것을 확인하였지만, 닭다리 근육세포가 닭가슴 근육세포보다 분화 능력이 더 오래 유지가 된 것을 확인할 수 있었다.
Fig. 7.
Differentiation of cultured chicken breast muscle cells and chicken leg muscle cells from day 1 to day 6 (40 × magnification).
(A), (B), (C) Microscopy images showing the differentiation of chicken breast muscle cells from day 1 to day 6 from passage 1, 3, 5. (D), (E), (F) Microscopy images showing the differentiation of chicken leg muscle cells from day 1 to day 6 from passage 1, 3, 5.
Download Original Figure
Ⅳ. 요 약
닭 근육세포를 다양한 혈청을 첨가한 배지에 배양하여 증식 능력을 비교한 결과, DMEM에 10% 닭 혈청과 5% 말 혈청을 첨가한 배지(T1)가 가장 증식 능력이 뛰어났다. T1 배지를 이용하여 닭가슴 근육세포와 닭다리 근육세포를 passage 1부터 passage 6까지 계대배양하여 세포 생존률과 살아있는 세포 수를 측정한 결과, 닭다리 근육 세포가 닭가슴 근육 세포보다 증식 능력이 뛰어났다. Passage 1부터 passage 6까지 계대배양한 닭가슴 근육 세포와 닭다리 근육 세포를 분화하였을 때, 닭다리 근육세포가 닭가슴 근육세포보다 분화 능력이 더 오래 유지되었다. 이러한 연구 결과는 닭 근육세포를 배양육 생산에 사용하기 위한 기초적인 데이터를 제공할 것이다.
Ⅴ. 사 사
이 성과는 정부(과학기술정보통신부)의 재원으로 한국연구재단의 지원을 받아 수행된 연구임(No. 2020R1G1A1006498). 본 결과물은 농림축산식품부의 재원으로 농림식품기술기획평가원의 고부가가치식품기술개발사업의 지원을 받아 연구되었음(321028-5).
Ⅵ. 참고문헌
Belova AV, Smutka L, Rosochatecká E. 2012. World chicken meat market–its development and current status. Acta Uni Agric Silvic Mendel Brun 60(4):15-30.


Bhat K, Sandler K, Duhachek-Muggy S, Alli C, Cheng F, Moatamed NA, Magyar CE, Du L, Li G, McCloskey S, Vlashi E, Pajonk F. 2019. Serum erythropoietin levels, breast cancer and breast cancer-initiating cells. Breast Cancer Res 21(1):1-13.




Bucevičius J, Lukinavičius G, Gerasimaitė R. 2018. The use of hoechst dyes for DNA staining and beyond. Chemosensors 6(2):18.


Choi JS. 2019. Research trends in alternative protein and cultured meat materials. Food Ind Nutr 24(2):15-20.

Choi SR, Lee SI, Shin SS. 2022. Effect of culture medium containing chicken serum on growth and differentiation of QM7 quail muscle cells. Korean J of Poult Sci 49(2):109-114.


Kadim IT, Mahgoub O, Baqir S, Faye B, Purchas R. 2015. Cultured meat from muscle stem cells: A review of challenges and prospects. J Integr Agr 14(2):222-233.


Lim CH, Son HJ. 2019. Treadmill exercise increases muscle satellite cell activation independent of oxygen concentration in rat. Exerc Sci 28(1):22-30.


McLeod A. 2011. World livestock 2011 – livestock in food security. Food and Agriculture Organization of the United Nations (FAO), Rome, Italy.

Mizuno Y, Chang H, Umeda K, Niwa A, Iwasa T, Awaya T, Fukada S, Yamamoto H, Yamanaka S, Nakahata T, Heike T. 2010. Generation of skeletal muscle stem/progenitor cells from murine induced pluripotent stem cells. Faseb J 24(7):2245-2253.