Ⅰ. 서 론
치매에서 가장 흔한 Alzheimer's disease (AD)는 점진적으로 진행하는 인지기능 저하와 일상생활 기능 및 신경정신행동의 변화를 특징으로 하는 신경퇴행성 질환이며, 신경퇴행의 과정은 AD의 증상이 나타나기 전에 진행되기 때문에 이를 발견하기 위한 시도가 다양하게 이루어지고 있다 (Kang et al., 2016). AD는 acetylcholine의 감소뿐만 아니라 γ-aminobutyric acid, glutamate 등 여러 신경전달물질의 불균형에 의한 복합적인 질환으로 밝혀졌다 (Kim and Kim, 2013). 또한 정상적인 신체 조건하에서 free radical이나 활성산소종 (reactive oxygen species, ROS)은 숙주 방어, 유전자 전사 등의 역할을 하지만, ROS가 세포의 항산화 활성을 압도하게 되면 산화적 스트레스가 발생하여 단백질 붕괴, 효소의 고장, 뉴런 파괴를 일으키는 등 산화적 스트레스가 AD 환자에게 신경 손상, 중앙신경시스템내 단백질, DNA 손상을 유발할 수 있다고 보고되었다 (Yoo et al., 2020).
한편, γ-aminobutyric acid (GABA)는 자연계에 분포하는 비단백 아미노산의 일종으로 뇌의 주된 억제성 신경전달물질로서 뇌의 혈류를 활발하게 하고, 산소공급량을 증가시켜 뇌세포의 대사기능을 촉진시키는 것으로 알려져 있다 (Jung et al., 2012). GABA는 흥분성 신경전달물질인 glutamate로부터 탈탄소화작용 (decarboxylation)으로 만들어지는데, 이때 관여하는 효소는 glutamate decarboxylase (GAD)로 pyridoxine (vitamin B6)이 조효소로 관여하며, 이 효소가 결핍되면 GABA 형성이 부족해져 발작이나 경련 등이 발생하고, 이러한 현상이 지속되면 간질, 치매 등 신경성 질환을 유발하는 것으로 보고된 바 있다 (Jung et al., 2012; Oh, 1996). 또한 GABA는 뇌기능 촉진뿐만 아니라, 혈압강하, 혈중 콜레스테롤 및 중성지방 억제, 뇌 혈류 개선, 항산화 효능, 이뇨작용, 불면, 우울, 불안 등에 대한 생리활성 기능이 있다 (Kang et al., 2020; Lee and Kim, 2013). GABA는 각종 야채, 과일, 쌀, 콩뿐만 아니라, 미생물부터 고등생물까지 널리 발견되었으나, 식품에서는 그 함량이 낮아 일반적인 섭취로 우수한 GABA의 생리작용을 기대하기는 어렵다 (Cho et al., 2012). 따라서 GABA의 대량생산 연구가 꾸준히 진행되어 왔으나, 합성 GABA는 식욕 부진, 설사 등의 부작용이 있어 발효제법을 이용한 GABA 생산에 대한 연구개발이 진행되고 있다 (Kang et al., 2020).
최근 김치, 치즈, 요거트 등 발효식품으로부터 GABA를 생산하는 Lactobacillus brevis, L. buchneri, L. fermentum, L. helveticus, L. paracasei, L. plantarum, L. lactis, L. rhamnosus, L. casei, L. sakei 등 다양한 유산균주가 분리 및 이용되었다 (Cho et al., 2007; Kook et al., 2010; Lin et al., 2017; Mancini et al., 2019; Siragusa et al., 2007; Sun et al., 2009). 이는 Lactobacillus속 등 여러 유산균이 glutamate decarboxylase 시스템을 가지고 있기 때문이며, 일반적으로 김치의 산성조건이 유산균의 GABA 생산에 유익한 것으로 보고되었다 (Cui et al., 2020; Hwang et al., 2020). 또한 최근 김치로부터 GABA 생성능이 우수한 L. brevis, L. lactis, L. sakei 등이 분리되었으며 (Hwang and Park, 2020; Kim et al., 2013; Shin et al., 2007; Yu and Oh, 2011), 천연물 발효, 김치, 전통주, 콩 등에서 유산균에 의한 GABA 생산 증대 및 항산화 효능이 연구된 바 있다 (Cho et al., 2012; Hwang et al., 2018; Lee and Kim, 2013; Lee et al., 2017).
따라서 본 연구에서는 우수한 GABA 생성능을 갖는 유산균을 분리하기 위해 국내 가정에서 직접 담근 12종의 김치시료로부터 GABA를 생산하는 유산균을 분리하고, 분리 균주의 GABA 생성능 및 항산화 효능을 측정하여 유용 미생물 자원으로서 그 가능성을 확인하고자 하였다.
Ⅱ. 재료 및 방법
김치로부터 GABA 생성능이 있는 유산균을 확인하기 위해 monosodium glutamate (MSG) 1% (w/v)를 첨가한 MRS broth (Lactobacilli MRS broth, BD Difco, USA) 5 mL에 열무김치, 배추김치, 총각김치, 오이소박이 등 각각 10 g을 90 mL의 PBS buffer에 첨가 후 스토머커 (Bagmixer400, interscience, France)를 이용해 파쇄한 액체시료를 100 μL 첨가하여 30℃에서 48시간 배양한 후, 배양액을 12,000 rpm, 5분간 원심분리하여 얻은 상등액을 시료로 사용하였다. GABA 생성 유무를 확인하기 위해 박층크로마토그래피 (thin layer chromatography; TLC)법을 수행하여 GABA 생성능이 확인된 김치시료를 1차 선별하였다.
GABA 생성능이 확인된 김치시료로부터 GABA 생성능이 있는 유산균을 분리하기 위해 상기 배양액을 이용하여 BCP (Bromo cresol purple) 평판배지 (BCP plate count agar, EIKEN chemical, Japan)에 획선 도말한 후, 30℃에서 24시간 배양한 후 노란색 환을 형성한 단일 콜로니를 취해 이를 순수 분리하여 후보 균주로 선정하였다. 분리한 유산균은 각각 MSG를 1% (w/v) 첨가한 MRS broth (BD Difco) 5 mL에 1% (v/v) 접종하여 30℃에서 72시간 배양 후, 배양액을 12,000 rpm, 5분간 원심분리하여 얻은 상등액을 시료로 사용하였다. 균주의 GABA 생성능을 확인하기 위해 박층크로마토그래피법을 수행하여 GABA 생성능이 확인된 유산균을 2차 선별하였다.
2차 선별된 분리균은 균주의 동정을 위해 MRS broth (BD Difco)에서 배양 후, 16s rRNA 염기서열 분석을 시행하였다. 분석은 분석기관 (BIOFACT Korea)에서 시행하였으며, 유전자의 증폭을 위해 8F (5'-AGAGTTTGATCCTGGCTCAG-3'), 1492R (5'-TACGGTTACCTTGTTACGACTT-3')등의 universal primer를 사용하였다. PRISM 3730XL analyser (Applied Biosystems)를 이용하여 염기서열을 분석하였으며, NCBI (National Center for Biotechnology Information)의 BLAST (Basic Local Alignment Search Tool) program을 통해 비교하였다.
선행된 GABA 생산 유산균의 1, 2차 선별을 위해 박층크로마토그래피법을 통해 GABA 생성능을 확인하였다. 이를 위해 유산균 분리주 배양액을 12,000 rpm, 5분간 원심분리하여 얻은 상등액을 0.2 µm membrane filter (syringe filter SM13P020SL, Hyundai micro, Korea)로 여과하여 시료로 사용하였다. 박층크로마토그래피는 TLC plate (TLC silica gel 60 F254, Merck, Germany)를 사용하였고, 전개용매는 n-butanol, acetic acid, D.W를 3:1:1 (v/v/v) 비율로 혼합하여 사용하였으며, 40분간 전개 후 TLC plate를 열풍건조하였다. 이후 ethanol에 용해시킨 0.1% ninhydrin 용액을 분무하여 10분간 건조한 후 나타나는 GABA 표준물질과 시료의 Rf값을 비교하였다.
유산균주 배양액의 DPPH radical 소거능은 Takashi 등 (2000)의 방법에 의해 측정하였다. 대조군으로 0.5% (w/v) Vitamin C를 사용하였으며, ethanol에 용해시킨 0.2 mM DPPH solution 0.5 mL에 유산균주 배양액 60 µL를 혼합하여 30분간 암반응 후, ELISA (UV/VIS-spectrophotometer, BioTek, USA)를 이용하여 520 nm에서 흡광도를 측정하였다.
Ⅲ. 결과 및 고찰
열무김치, 배추김치, 총각김치, 오이소박이 등 총 12개의 김치시료로부터 GABA 생성능이 있는 유산균을 선별하기 위해 MSG가 1% 첨가된 MRS broth에서 48시간 배양하여 시료의 GABA 생성 유무를 확인하였다. 그 결과, GABA 표준물질과 동일한 Rf 값을 갖는 GABA가 생성된 시료는 9번 (총각김치), 11번 (열무김치), 12번 (오이소박이), 17번 (총각김치)으로 확인되었다 (Fig. 1).
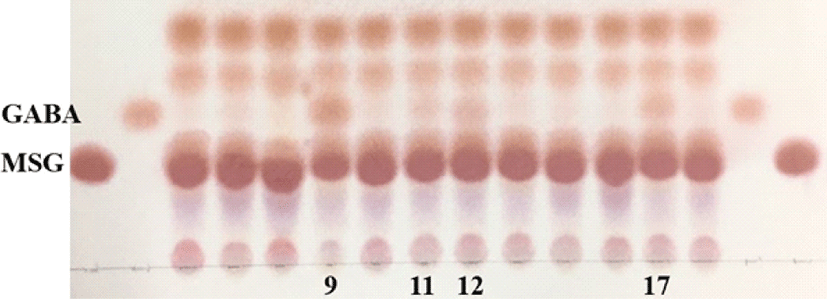
Hwang과 Park (2020)은 총 21종의 김치에서 GABA를 생산하는 유산균인 L. lactis를 분리하였고, Kim 등 (2013)은 김치로부터 GABA 생성능이 우수한 L. sakei를 분리하였다.
한편, Lee와 Kim (2013)의 연구에 의하면 김치의 저장기간에 따라 GABA 함량이 다르고, 김치 발효과정 중 GABA 생성이 진행되는 것으로 보고된 바 있다. L-glutamate가 풍부한 발효식품은 GABA 생산 유산균의 중요한 공급원이 되고, 균주의 GABA를 생산하는 능력은 매우 다양하며, 대부분의 유산균에 의한 GAD 활성은 pH 4.0-5.0에서 최고의 활성을 보였으며, 중성에 가까운 pH 7.0에서는 유의적으로 낮은 활성을 보였다고 하였다 (Cui et al., 2020). 본 연구결과에서 김치종류에 따른 GABA 생성 유무는 각 시료의 균 종 및 발효기간에 의한 pH조건에 의한 것으로 생각된다.
GABA 생성능이 확인된 김치시료 중 우수한 3종 (9번, 11번, 17번)을 선정하여 각 시료로부터 유산균을 분리하기 위해 BCP 평판배지에 도말하여 배양 후, 노란색 환을 형성한 콜로니를 채취해 2차 계대배양하여 각각의 균을 순수분리하였다. 이후, 순수 분리한 균주의 GABA 생성능을 확인한 결과를 Fig. 2에 제시하였다. 9번 시료로부터 GABA 생성능이 확인된 균주는 9-2, 9-6, 9-8, 9-10, 9-12, 9-15, 9-17로 7주, 11번 시료로부터 GABA 생성능이 확인된 균주는 11-3, 11-4, 11-5, 11-6, 11-7, 11-8, 11-9, 11-10으로 8주, 17번 시료로부터 GABA 생성능이 확인된 균주는 17-3, 17-9로 2주가 확인되어, 총 17주의 균주가 GABA를 생성하는 것으로 확인되었다. 따라서 GABA 생산 균주 17주의 16s rRNA 유전자 염기서열을 분석한 결과, 분리 균주는 Levilactobacillus brevis (구 Lactobacillus brevis) ATCC 14869와 99% 이상의 상동성을 보였다 (Table 1).
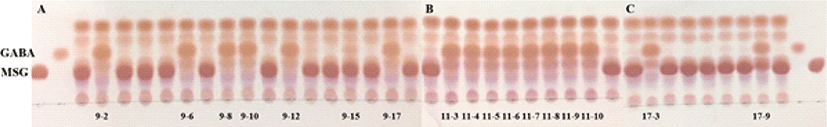
최근 김치로부터 GABA를 생산하는 균주인 L. brevis, L. lactis, L. sakei등이 분리되었는데 (Kim et al., 2013; Hwang and Park, 2020; Shin et al., 2007; Yu and Oh, 2011), Cui 등 (2020)에 의하면 많은 연구에서 L. brevis가 높은 함량의 GABA를 생산한다고 하여 본 연구결과와 일치하였다.
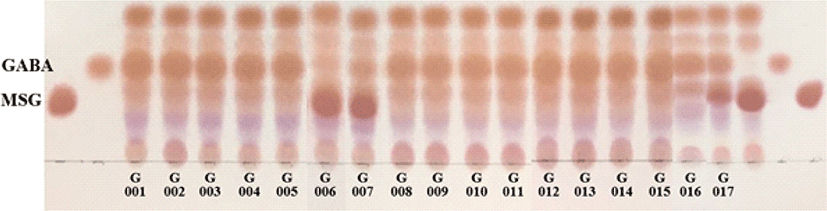
우리나라 전통식품인 다양한 김치시료로부터 분리한 17주의 Levilactobacillus brevis의 GABA 생성능을 확인하였다 (Fig. 3). L. brevis는 GABA 생성능이 우수한 것으로 알려져 균주의 GABA 생산 최적화, 발효에 의한 GABA 함량 및 항산화 효능, GABA 생산조건 등 많은 연구가 진행된 바 있다 (Mancini et al., 2019; Hwang et al., 2018; Jeong et al., 2016; Lee et al., 2010; Qinglong et al., 2018; Shin et al., 2007). 본 연구에서도 김치에서 분리한 L. brevis BMSE-G001 등 17주의 우수한 GABA 생성능을 확인할 수 있었으며, 균주의 배양조건과 GABA 함량의 상관관계에 대한 후속연구가 필요할 것으로 생각된다.
치매에서 가장 흔한 AD는 점진적으로 진행하는 인지기능 저하와 일상생활 기능 및 신경정신행동의 변화를 특징으로 하는 신경퇴행성 질환으로 (Kang et al., 2016), AD 환자군에서 항산화제 수치가 낮다는 보고가 있으며, AD 발현의 초기에 산화적 손상이 두드러지게 동반된다고 하였다 (Kim et al., 2011). 따라서 본 연구에서는 분리한 GABA 생성 균주의 항산화 효능을 확인하고자 하였다.
본 연구에서 사용한 DPPH radical 소거능은 free radical 소거능을 확인하는 방법으로 널리 이용되며, 수소전자 공여능에 의한 항산화 효능을 확인할 수 있다 (Lee et al., 2010). Fig. 4에 제시한 바와 같이, 대조군 0.5% vitamin C의 DPPH radical 소거능은 94.21%, 분리 균주 L. brevis BMSE-G001 등 17주의 GABA 생성 균주 발효액의 DPPH radical 소거능은 G005가 92.81%로 가장 높았고, G008, G010, G013, G016은 91.55%, G007은 91.36%, G004는 91.26%, G011과 G012는 90.97%, G001은 90.39%로 나타나 매우 우수한 결과를 보였다. G003과 G017은 89.12%, G014는 88.05%, G002는 86.79%, G009는 83.98%, G015는 83.30%로 나타났다. Jang 등 (2019)은 L. brevis KU15153의 소거능 값을 44.14%, Yang 등 (2020)은 L. brevisKU15151의 소거능 값을 31.14%, Noureen 등 (2018)은 L. brevis MG000874의 소거능 값을 69.40%로 확인한 바, 본 연구에서 분리한 L. brevis BMSE-G001 등 17주의 GABA 생성 균주 발효액의 DPPH radical 소거능이 매우 우수한 것으로 보인다.
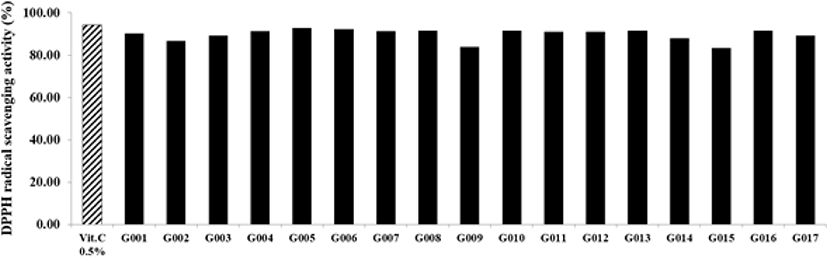
Ⅳ. 요 약
본 연구에서는 우수한 GABA 생성능을 갖는 유산균을 분리하기 위해 국내 가정에서 직접 담근 김치시료로부터 우수한 GABA 생성능을 갖는 유산균 17주를 분리하였으며, 유용 미생물 자원으로서 그 가능성을 확인하였다. 총 12개의 김치시료에서 GABA 표준물질과 동일한 Rf 값을 갖는 시료는 9번 (총각김치), 11번 (열무김치), 12번 (오이소박이), 17번 (총각김치)으로 확인되었다. 각 시료로부터 분리한 균주의 16s rRNA 분석 결과, Levilactobacillus brevis ATCC 14869와 99% 이상의 상동성을 보였다. 또한 분리 균주 L. brevis BMSE-G001 등 총 17주의 우수한 GABA 생성능을 확인할 수 있었으며, 균주의 배양조건과 GABA 함량의 상관관계에 대한 후속연구가 필요할 것으로 생각된다. 분리 균주의 항산화 효능을 알아보기 위해 L. brevis BMSE-G001 등 총 17주의 DPPH radical 소거능을 측정한 결과, G005가 92.81%로 가장 높았고, G008, G010, G013, G016, G007, G004, G011, G012, G001 또한 90% 이상의 소거능을 보였다. G003, G017, G014, G002, G009, G015는 80% 이상의 활성이 확인되어 17주의 DPPH radical 소거능은 매우 우수한 것으로 확인되었다. 따라서 본 연구에서 분리한 L. brevis BMSE-G001 등 17주의 우수한 GABA 생성능 및 항산화 효능을 확인하여 유용 미생물 자원으로서 그 가능성을 확인할 수 있었다.






