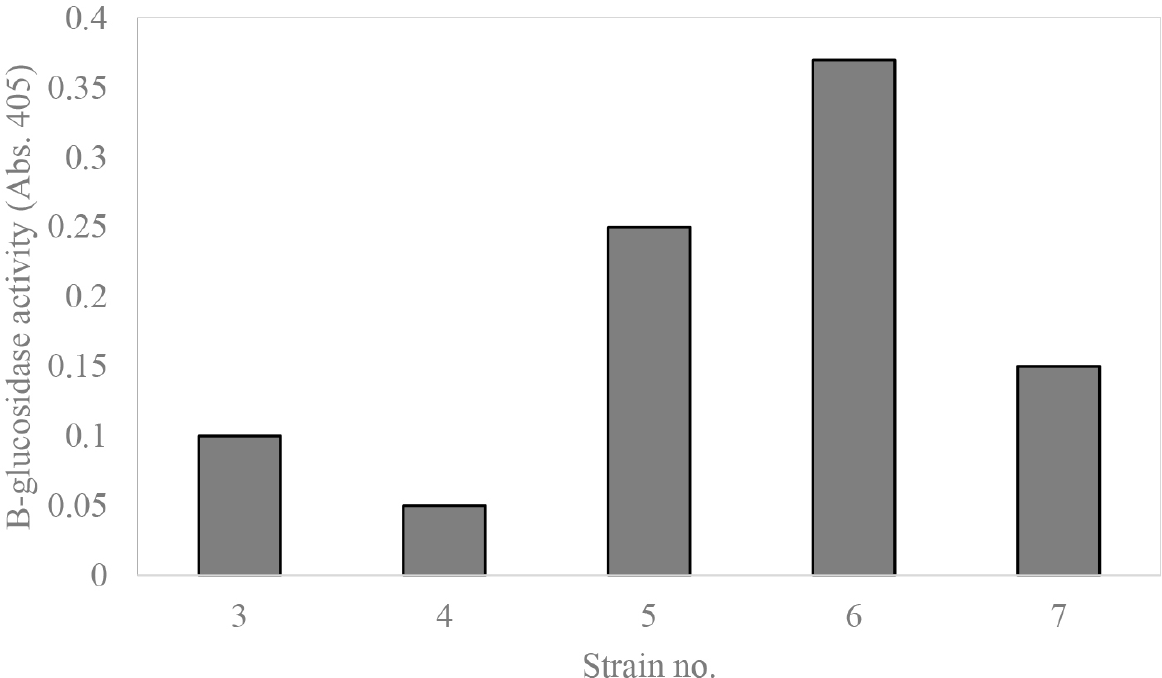Ⅰ. 서 론
대두는 간장, 두부, 된장, 청국장 등의 발효식품으로, 콩나물, 콩자반 등의 찬으로 널리 이용되어온 매우 유용한 작물로, 뛰어난 영양성분 및 생리활성물질들을 함유한 대두는 최근 다양한 기능성이 연구되어 왔으며, 이를 이용한 다양한 발효제품들이 제안되고 있다.
대두는 당 성분을 포함하는 배당체(glycoside)가 존재하는데 대표적인 물질로는 phytoestrogen이라 불리는 isoflavone이 알려져 있다. 대두 이소플라본은 비배당체(aglycone)인 dadizein, genistein, glycitein 등 3개와 배당체 9개(genistin, daidzin, glycitin; glucoside, acetylglucoside, malonylglucoside)등으로 12개의 유도체로 존재한다(Kudou et al., 1991). 대두 이소플라본은 주로 배당체 형태로 존재하고 있으며, 이러한 isoflavone은 위산과 장내 미생물에서 기인하는 효소인 β-glucosidase에 의하여 체내 활성 물질인 daidzein과 genistein 등의 비배당체로 전환되어 장에서 흡수된다. 하지만, 체내 흡수율이 매우 낮아 이를 보완하기 위해 배당체 형태의 이소플라본을 비배당체 형태로 전환하는 생물학적 전환 공정 기술 및 가공 기술이 요구된다(Kim et al., 2010).
Kang 등(2003)은 배당체가 비배당체로 분해되는 비율이 높을수록 인체 내 이소플라본의 생리활성이 증가된다고 보고하였으며, Toda 등(2000)은 가열 과정에서 콩 제품 내 이소플라본 결합물의 분포에 변화가 일어나서 체내 흡수율을 높이는 것으로 나타났다. 또한 Adlercreutz(1995) 및 Wei 등(1993)은 isoflavone 유래 비배당체인 genistein의 항암 효과를 검토하였다.
체내 생리활성을 증진시키기 위하여 가수분해, 효소 반응 및 미생물에 의한 생물학적 전환 (bioconversion) 등의 비배당화 방법 등이 연구되고 있으며(Choi et al, 1999; Yeo and Kim, 2002), 대두 발효유 제조에 미생물을 이용하여 비배당화 과정을 적용하면 장내 생리활성을 증진시킬 수 있을 것으로 기대할 수 있다.
유산균은 발효 과정 중 젖산 등 다양한 대사산물을 생산하는 미생물로 알려져 있다. 이러한 유산균은 다양한 발효 식품, 사료 첨가제 등의 제조에 사용되고 있으며, 최근에는 건강 증진 및 질병 예방의 특징을 가지는 probiotics 균주의 연구와 응용이 증가하고 있다(Fuller, 1989). 최근 다양한 형태의 건강기능식품 수요가 증가하면서 인삼, 콩, 한약재, 녹차 등의 다양한 식품소재를 유산균 발효에 적용하여 식품의 기능성을 강화하고, 관능적 품질을 향상시킨 발효식품으로 개발하려는 시도가 이루어지고 있다(Kim and Han, 2005; Shah, 2006).
따라서 본 연구에서는 체내 이용률을 높이기 위하여 이소플라본 비배당체를 많이 생성할 수 있는 우수한 유산균을 선별하고 이를 대두 발효유를 제조하기 위하여, 이소플라본 비배당체 함량을 증가시킬 수 있는 β-glucosidase 활성을 지니는 유산균을 김치로부터 분리하고 대두 발효를 통하여 이소플라본 함량의 변화를 검토하였다.
Ⅱ. 재료 및 방법
본 실험에서 사용된 대두분말은 국내 식품첨가물 회사로부터 구입하여 발효에 사용하였다. 분석용 이소플라본 표준품은 Sigma(USA) 및 Fluka(Japen)의 제품을 구입하여 사용하였다. 유산균 분리에 이용된 시료는 서울 등지의 가정집 및 식당 등에서 구하여 사용하였다.
Bui 등(2011)의 방법을 변형하여 유산균의 분리에 사용하였다. 수집한 김치 시료 1 g을 9 mL의 멸균 생리 식염수에 가하여 다진 후 1 mL의 시료액을 취하여 9 mL의 멸균 생리 식염수에 가하고, 순차적으로 희석하여 0.1%(w/v) esculin과 0.05%(w/v) ferric citrate가 첨가된 Lactobacilli MRS 평판배지(Dfico, USA: 1.0% bacto peptone, 1.0% beef extract, 0.5% yeast extract, 2.0% glucose, 0.1% polysorbate 80, 0.5% sodium acetate, 0.2% ammonium citrate, 0.2% K2HPO4, 0.02% MgSO4·7H2O, 0.02% MnSO4·4H2O, 1.5% agar powder)에 도말한 후, 30℃에서 배양하였다. Black zone이 나타난 유산균 집락을 선별하여, 1-2차례 순수 배양하여 균을 분리한 후, MRS 액체 배지에 접종하여 30℃에 배양한 후 25%(v/v) glycerol stock을 제조하여 —70℃에 보관하여 본 연구에 사용하였다.
분리 균주를 MRS 액체 배지에서 배양 후, p-nitrophenol을 이용한 β-glucosidase 활성을 검토하였다. 2.5 mM p-nitrophenyl α-Dglucospyranoside(pNPG) 100 μL를 첨가하고, 배양액 50 μL에 50 μL를 첨가 후 37℃에서 반응시키고, 0.1 M NaOH 100 μL를 첨가하여 반응을 종결시켜 substrate인 pNPG로부터 유리되어 나오는 반응 생성물인 p-nitrophenol을 405 nm에서 측정하여 α-glucosidase 활성을 측정하였다.
대두 이소플라본의 생물학적 전환을 위하여 분리 유산균의 발효용 배지를 제조하여 사용하였다. 구입한 대두 분말 10 g에 40 mL의 증류수를 가한 후, 살균 처리하였다. 분리한 유산균을 1×109 CFU/mL 수준으로 MRS 액체 배지에서 전배양 후, 살균된 배지에 1% (v/v) 수준으로 접종한 후 30℃에서 20시간 동안 배양하였다.
대두 이소플라본의 생물학적 전환율을 검토하기 위하여, 유산균 발효액은 12,000 rpm에서20분 간 원심분리 후 상등액을 제거하고 침전물에 90% 수준으로 EtOH을 가하였다. 이를 상온에서 24시간 동안 교반 추출한 후 상등액을 취한 후 농축하여 RP-HPLC를 수행하였다. RP-HPLC 분석은 RP-HPLC(Waters 2487 Dual λ Absorbance detector, Waters 1525 Binary HPLC pump, Waters 717 plus Autosampler, USA)를 사용하였다. HPLC column ODS hypersil 컬럼(4.6× 250mm, 5μm)을 사용하였으며, UV 검출계를 이용하여 260 nm를 검출하였다.
이동상의 유속은 1 mL/min로 하여 60분간 분석하였다. 이동상 A는 증류수, MeOH, Acetic acid를 88:10:2의 비율로, 이동상 B는 MeOH과 Acetic acid를 98:2의 비율로 혼합하여 사용하여, 0-15.0분 80:20, 15.0-25.0분 60:40, 25.0-33.0분 40:60, 33.0-36.0분 90:10, 36.0-43.0분 100:0, 43.0-60.분 80:20(%)의 농도 구배를 주어 분석하였다.
Ⅲ. 결과 및 고찰
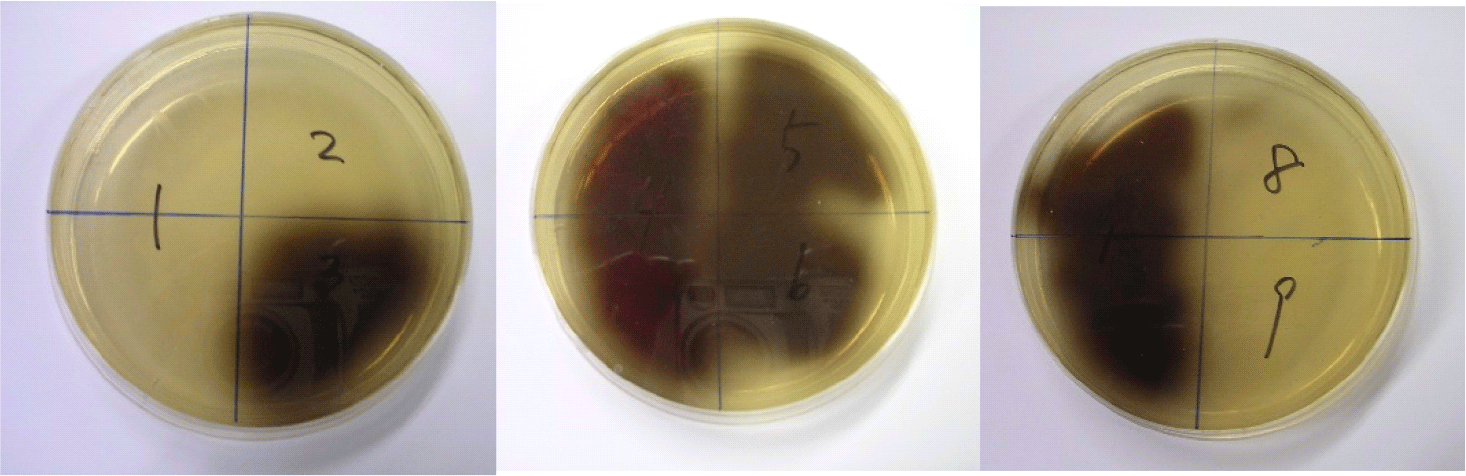
대두 유래 이소플라본의 생물학적 전환을 위하여 가정집 및 서울 근교의 식당 등지에서 열무김치, 배추김치 등 다양한 김치 시료를 수집한 후 Esculin을 이용하여 β- glycosidase 활성을 가진 균주를 분리하였다. 수집된 시료를 BCP 평판 배지에서 황색환을 형성하는 콜로니(colony)를 1차 분리 후, 2-3차례 순수분리하였다. 순수 분리된 후보균주는 Esculin이 함유된 MRS 평판배지에 접종하여 배양한 후, 검은색 환을 형성하는 균주를 1차 선별하였다(Fig. 1). 선별된 분리 균주는 Gram 양성, catalase 음성, 무포자 간균 혹은 구균임을 확인하였다(data 보이지 않음).
대두 유래 이소플라본의 생물학적 전환을 검토하기 위하여 1차 분리 균주를 MRS 액체 배지에서 배양 후, p-nitrophenol을 이용하여 β-glucosidase 활성을 비교 검토하였다(Fig. 2). 1차 선별된 균주 5주를 이용하여 배양여액 중의 β-glucosidase 활성을 비교한 결과, 분리 균주 5, 6, 7 등의 균주의 활성이 가장 우수하였다.
대두 이소플라본의 생물학적 전환을 위하여 분리 유산균의 발효용 배지를 제조하여 사용하였다. 구입한 대두 분말 10g에 40 mL의 증류수를 가한 후 살균 처리하였다. 선행된 연구의 결과를 바탕으로 2차 선별된 분리균주를 1×109 CFU/mL 수준으로 MRS 액체 배지에서 전배양 후, 살균된 배지에 1%(v/v) 수준으로 접종한 후 30℃에서 20시간 동안 배양하였다. 배양 결과, Strain 5의 경우, daidzein은 초기 0.031%에서 0.35%로 대략 20% 증가하였으며, genistein은 0.035%에서 0.65%로 19% 증가했으며, Strain 6의 경우, daidzein은 초기 0.031%에서 0.75%로 대략 24% 증가하였으며, genistein은 0.035%에서 0.66%로 19% 증가하였다. 또한, Strain 7의 경우, daidzein은 초기 0.031%에서 0.44%로 대략 15% 증가하였으며, genistein은 0.035%에서 0.50%로 14% 증가하였다(Table 1). 이러한 결과로 미루어 볼 때, strain 6 균주가 대두 유래 이소플라본의 생물학적 전환에 의한 daidzein과 genistein의 생산에 가장 우수한 균주로 사료된다.
| Strain No. | Content before fermentation (%, w/v) | Content after fermentation (%, w/v) | ||
|---|---|---|---|---|
| Daidzein | Genistein | Daidzein | Genistein | |
| 5 | 0.031 | 0.035 | 0.65 | 0.66 |
| 6 | 0.031 | 0.035 | 0.75 | 0.66 |
| 7 | 0.031 | 0.035 | 0.44 | 0.50 |
Ⅳ. 요 약
체내 이용률을 높이기 위하여 이소플라본 비배당체를 많이 생성할 수 있는 우수한 유산균을 선별하기 위하여 김치로부터 β-glucosidase 활성이 높은 유산균을 분리하고, 대두 발효를 통하여 이소플라본 함량의 변화를 검토하였다. 수집된 시료를 Esculin이 함유된 MRS 평판배지에 접종하여 배양한 후 검은색 환을 형성하는 균주를 1차 선별하였으며, 선별된 균주의 배양여액 중의 β-glucosidase 활성을 비교한 결과, 분리 균주 5, 6, 7 등의 균주의 활성이 가장 우수하였다. 대두 이소플라본의 생물학적 전환을 검토하기 위하여 대두 분말 배지에서 배양 결과, , Strain 6의 경우, daidzein은 초기 0.031%에서 0.75%로 대략 24% 증가하였으며, genistein은 0.035%에서 0.66%로 19% 증가하여 대두 유래 이소플라본의 생물학적 전환에 의한 daidzein과 genistein의 생산에 가장 우수한 균주로 사료된다. 이에 대한 추가적인 연구가 요구된다.