Ⅰ. 서 론
과메기는 포항을 중심으로 한 동해안 지역에서 오랜 기간 동안 소비되어 온 전통 수산식품 중 하나이다(Oh et al., 1998). 과메기는 원래 청어를 동절기에 15일 이상 자연 건조하여 수분함량이 약 40% 정도가 되도록 가공한 것이었으나, 19세기 이후 국내 청어 어획량이 감소함에 따라 청어와 유사한 기름기 있는 등푸른 생선인 꽁치를 대체 원료로 사용하게 되었다. 현재 시판되고 있는 과메기의 대부분은 꽁치를 원료로 제조된 꽁치과메기로, 상업적 유통 또한 활발하게 이루어지고 있다.
꽁치와 청어는 계절별로 어획량의 변동이 크기 때문에 과메기는 계절적 특성을 지닌 식품으로 분류된다. 따라서 연중 안정적인 원료 수급을 위해 신선한 원양산 꽁치를 냉동 보관하였다가 해동한 후, 자연건조 또는 인공건조 과정을 통해 과메기를 제조하는 방식이 일반화되어 있다. 시중에서 유통되는 과메기는 원료 어종에 따라 꽁치 과메기와 청어 과메기로 구분되며, 손질 정도에 따라 과메기의 꼬리, 껍질까지 모두 제거하여 바로 먹을 수 있는 손질과메기와 과메기의 껍질과 꼬리는 제거되지 않아 직접 제거하여 먹는 형태인 반손질과메기의 형태로 판매되고 있다. 과메기는 명태를 반건조시킨 코다리나 반건조오징어 등과 유사한 반건조 수산가공품에 해당하지만, 가염이나 열처리 등의 별도 가공 과정을 거치지 않고 바로 섭취한다는 점에서 차이점이 있다(Kim et al., 2020).
청어와 꽁치는 조지방이 9% 함유되어 있다. 그 중 Eicosapentaenoic acid (EPA) 및 Docosapentaenoic acid (DHA)와 같은 고도불포화지방산은 여러 가지 건강 기능성이 인정되나, 가공 및 저장 조건에 따라 산패되기 쉽다(Heu et al., 2012). 그렇기 때문에 과메기를 제조하는 과정에서 지방의 산패가 일어날 수 있고, 이에 대한 관리가 필요하다.
생선에 포함된 단백질인 히스티딘이 시간이 경과하여 탈탄산작용이 일어나면 히스타민이 된다. 어육이 완전히 부패된 단계에서는 histaminase의 작용으로 인해 히스타민이 저분자 물질로 분해되기 때문에 히스타민의 함량은 오히려 감소될 뿐 아니라, 그 부패취 때문에 섭취하는 일이 거의 없어 식중독을 유발하는 경우가 적다. 반면, 초기 단계에서는 일단 생성된 히스타민이 쉽게 분해되지 않고 다량으로 축적되기 때문에 이를 섭취할 경우 알러지성 식중독을 일으킬 수 있어 식품위생상 문제가 되고 있다. 하지만 현재까지 과메기로 인한 알러지성 식중독 발생 사례는 거의 찾아볼 수 없으나(Kim and Kim, 2006), 히스타민으로 인한 알러지성 식중독의 위험성이 존재하기 때문에 안전 기준을 마련할 필요성이 있다.
KS H 6036 (Korean Agency for Technology and Standards, 2020)에서는 과메기의 품질 기준을 수분햠량 37% 이하, 산가 5.0 mg KOH/g 이하, 히스타민 20 mg/100 g 이하로 규정하여 품질을 관리하고 있으며, 미생물학적 품질은 황색포도상구균 5.0 × 102 CFU/g 이하, 대장균군 1.0 × 101 CFU/g 이하로 규정하고 있다.
이에 본 연구에서는 시중 유통되고 있는 과메기 제품의 품질 및 미생물적 특성 분석을 통해 과메기 품질 및 안전 기준의 적절성 검토의 기초자료를 마련하고자 하였다.
Ⅱ. 재료 및 방법
과메기 시료는 시중유통현황을 반영하여 비늘과 꼬리까지 모두 제거한 손질과메기와 머리와 내장만 제거한 반손질 과메기로 분류하였다. 원물에 따른 품질 차이를 확인하기 위해 꽁치와 청어를 원물로 한 과메기를 온라인 상으로 구매하였으며, 본 실험에 사용된 과메기 제품에 대한 정보는 요약하여 Table 1에 나타내었다. 실험에 사용된 과메기 제품은 꽁치과메기 26종과 청어과메기 18종 총 44종으로 수분, 산가 및 히스타민 함량의 이화학적인 품질과 미생물학적 품질을 분석하였다.
| Types of Gwamegi | Number of samples | Degree of trimming | |
|---|---|---|---|
| Trimmed | Semi-trimmed | ||
| Saury | 26 | 16 | 10 |
| Herring | 18 | 12 | 6 |
| Total | 44 | 28 | 16 |
수분함량은 상압가열건조법을 사용하여 측정하였다. 미리 가열하여 항량으로 한 칭량접시에 균질된 과메기 5 g을 취해 드라이오븐(ThermoStable OF-W155, DAIHAN Scientific, Korea)에서 105℃로 건조시켜 남은 시료의 무게를 재어 백분율로 표시하였다.
유지추출을 위해 시료를 세절하여 에틸에테르(Ether [Ethyl ether] 99.0%, SAMCHUN, Korea)를 넣고 2시간 방치한 후, 분액깔때기를 이용해 에테르층만 분취하여 무수황산나트륨(Sodium sulfate anhydrous, Daejung, Korea)으로 탈수한 후, 40℃ 수욕상에서 감압농축하여 에테르를 완전히 날려보낸 것을 실험에 사용하였다. 추출한 지방 시료 5 g을 취하여 삼각플라스크에 넣은 후 에틸에테르와 에탄올(Ethanol absolute, Daejung, Korea) 2:1 혼합용액 100 mL를 가하여 완전히 용해시키고, 1% 페놀프탈레인 용액(Phenolphthalein, Sigma-Aldrich, China) 지시약 3∼4 방울을 가하여 0.1 N KOH-에탄올 용액(0.1 N-potassium hydroxide ethanolic solution, Daejung, Korea)으로 적정하여 용액이 엷은 분홍색이 30초간 유지될 때를 종말점으로 하였다.
히스타민 분석을 위한 추출용액은 균질한 과메기 5 g에 0.1 N 염산(0.1 N-Hydrochloric acid standard solution, Daejung, Korea) 25 mL를 가하여 교반 및 원심분리(4,000 g, 4℃, 15분; Centrifuge 5810 R, Eppendorf, Germany)한 후 1차 상등액을 얻었고, 이어서 상등액을 취하고 남은 시료에 위 조작을 반복하여 2차 상등액을 얻은 후, 1차 상등액에 가하고, 50 mL로 정용한 것을 추출용액으로 하였다.
유도체화는 히스타민(Histamine, Sigma-Aldrich, USA) 표준용액 및 추출용액 1 mL를 마개 달린 유리 시험관에 취한 후 내부표준용액(1,7-diaminoheptane, Sigma-Aldrich, USA) 100 μL를 첨가하였다. 이어서 포화탄산나트륨 용액(Sodium carbonate monohydrate, Sigma-Aldrich, India) 0.5 mL와 1% 염화단실(Dansyl chloride, 99.0%, Sigma-Aldrich, USA) 아세톤 용액 0.8 mL를 가하여 혼합한 후 마개를 하여 45℃에서 1시간 동안 실시하였다. 유도체화 시킨 표준용액 및 추출용액에 10% 프롤린(L-Proline, Sigma-Aldrich, USA) 용액 0.5 mL 및 에틸에테르 5 mL를 가하여 약 10분간 진탕하고 상층액을 취하여 질소농축한 뒤 아세토니트릴(Acetonitrile, Fisher Scientific, Korea) 1 mL를 가하여 분석하였다.
히스타민은 C18-MG II(i.d., 4.6 × 250 mm, 5 um; Osaka Soda, Japan)컬럼이 장착된 고성능 액체크로마토그래피(LC-2000Plus Series High Performance Liquid Chromatograph(HPLC), Jasco, Japan)를 사용하였다. 히스타민 분석을 위한 염화단실 유도체의 이동상 조건은 55% 아세토니트릴을 최초 10분간 유지 후 15분까지 65%, 20분까지 80%, 25분까지 85%, 30분까지 90%, 35분까지 95%로 상승시킨 다음, 3분간 유지시킨 후 38분까지 55%로 낮추어 2분간 유지하였다. 이 때, 유속은 1 mL/min으로 하였고, UV detector(UV-2075 Plus, Jasco, Japan)의 파장은 254 nm로 하였다. 히스타민의 검출 및 정량 한계는 HPLC 표준곡선을 이용하여 계산하였다. 검출 한계 및 정량 한계는 가장 낮은 농도 표준품(0.625 μg/mL)의 반복 측정값에서 얻은 면적의 표준편차를 σ로 하고 표준곡선의 기울기를 σ/S로 하여 각각 3.3 σ/S 및 10 σ/S의 공식으로 산출하였다.
총호기성균 및 대장균군, 대장균 측정을 위해 시료 20 g에 멸균생리식염수(Sterilized diluent, DW-90, HAPS, Korea) 80 mL를 가하여 균질기 Sample Mixer(WH4000-2751-9, 3M, Korea)를 이용해 1분간 균질화 하였다. 균질된 시료액 1 mL와 멸균생리식염수를 10진 희석법에 따라 희석하여 실험에 사용하였다.
총호기성균은 호기성세균 측정용 건조필름(Petrifilm Aerobic Count, Neogen, USA)에 시료액 1 mL를 접종 후 37±1℃에서 48시간 배양한 후 붉은색 콜로니를 계수하였다. 대장균군 및 대장균은 대장균 측정용 건조필름(Petrifilm E. coli / Coliform, Neogen, Poland)에 시료액 1 mL를 접종한 후 37±1℃ 에서 24시간 배양하였다. EC film에서 기포를 형성한 붉은색 콜로니는 대장균군으로, 기포를 형성한 파란색 콜로니는 대장균으로 계수하였다.
Ⅲ. 결과 및 고찰
시중 유통 과메기 제품의 수분 함량은 원물에 따른 차이를 보였으며, 그 결과는 Fig. 1(a)에 나타나 있다. 손질과 반손질 꽁치과메기의 수분 함량은 각각 39.95±3.65% 및 37.20±4.38%로 측정되었으며, 청어과메기의 경우 손질과 반손질 제품에서 각각 35.16±4.17% 및 30.79±6.95%로 나타났다. 각 원물 내에서 손질과 반손질의 가공 방법 차이는 과메기의 수분 함량에 유의한 영향을 미치지 않았으나, 원물에 따른 수분함량을 비교한 결과, 청어과메기가 꽁치과메기보다 낮아 유의한 차이를 보였다.
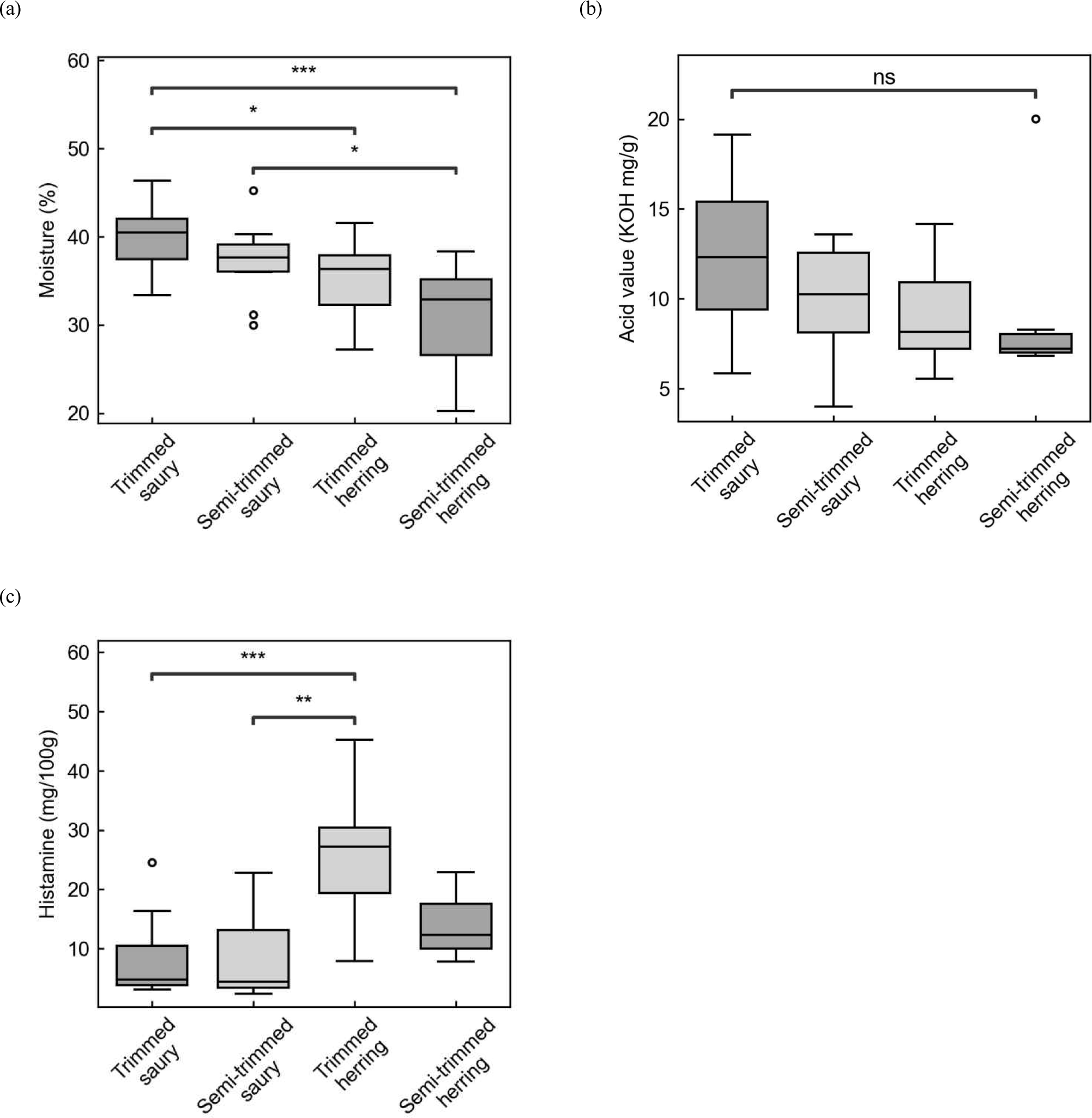
Oh 등(1998)은 꽁치를 자연건조한 결과, 건조 15일째에 수분함량이 38.8%로 과메기의 적정 건조 상태에 도달하였다고 제시하였다. Jang 등(2010)은 시중에서 판매되는 과메기의 일반성분을 분석한 결과, 수분 함량이 26.4%였다고 확인하였다. Heu 등(2012)은 시판 청어 과메기의 수분함량을 46.4∼47.2%로 보고하였으며, Yoon 등(2009)은 시판 꽁치 과메기의 수분 함량이 24.2∼43.7%의 범위를 나타냈다고 보고하였다.
과메기 제품의 산가는 Fig. 1(b)에 제시하였다. 손질된 꽁치과메기의 산가는 12.36±4.22(5.84∼19.14) KOH mg/g, 반손질 꽁치과메기의 산가는 9.86±3.16(3.99∼13.57) KOH mg/g으로 측정되었다. 손질 및 반손질 청어과메기의 산가는 각각 9.22±2.78(5.54∼14.16) 및 9.41±5.22(6.81∼20.01) KOH mg/g으로 나타났다.
어류의 유지는 불포화도가 높아 공기 중에서 쉽게 산화되며, 과산화물이 생성 후 산화 분해 및 분합 반응을 일으켜 각종 이취 및 유해 물질이 생성되어 이로 인해 식품으로서 가치가 저하될 수 있다(Lee et al., 2008). 과메기는 약 67.2∼89.7%의 불포화지방산을 함유하고 있으며(Heu et al., 2012; Jang et al., 2010; Yoon et al., 2010), 불포화도가 높은 과메기의 산가, 과산화물가, TBA가는 품질 평가의 중요한 요인이 된다.
Lee 등(2008)은 꽁치과메기의 산가를 15.71±0.82 KOH mg/g으로 보고하였으며, 과메기를 0℃와 –15℃, –30℃에서 보관한 경우에도 시간이 지남에 따라 산가가 증가하는 경향을 보였다. Oh 등(1998) 역시 저장 0일차 꽁치 원물의 산가를 7.27±0.49 KOH mg/g으로 보고하였으며, 건조 15일차에는 자연 건조 시 17.80±0.98 KOH mg/g, 인공 건조 시 15.71±0.82 KOH mg/g으로 증가하는 양상을 확인하였다. 과메기에서의 산가는 정제 유지에서 오는 것이 아닌 자연적인 현상이므로, 이 산가의 수준을 위해하다고 판단하기는 어렵다. 반면, Cho 등(2009)은 과메기 제조 시 산가가 5 KOH mg/g 이하로 유지됨을 확인하였으며, 이는 본 연구에서 관찰된 산가 값과 차이를 나타내었다.
히스타민의 검출 한계와 정량 한계는 각각 0.72 μg/mL 및 2.18 μg/mL로 나타났다. 시판 과메기에서 히스타민 함량을 HPLC로 분석한 결과, 손질 청어과메기의 히스타민 함량은 25.75±12.89 mg/100g (7.90∼45.18 mg/100g)으로 다른 시료군과 유의한 차이를 보였다. 반면, 반손질 청어과메기의 히스타민 함량은 13.99±5.82 mg/100g으로 꽁치과메기(손질: 8.06±6.41 mg/100g, 반손질: 9.59±7.81 mg/100g)와 통계적으로 유의한 차이는 없었으나, 수치적으로는 다소 높은 경향을 나타냈다(Fig. 1c).
Heu 등(2012)은 시판 청어 과메기에서 biogenic amine 함량을 분석한 결과, 히스타민의 함량이 12.4∼17.0 mg/kg임을 보고하였으며, Yoon 등(2010)은 시판 꽁치 과메기에서 33∼124 mg/kg의 히스타민이 검출되었음을 밝혔다. Shim 등(2011)은 꽁치 과메기의 건조 과정에서 히스타민 함량이 건조 1일차 36.0∼64.1 mg/kg, 2일차 16.7∼70.7 mg/kg, 3일차 52.4∼71.9 mg/kg으로 관찰되어, 건조 일수에 따라서는 유의적인 차이가 있었으나(p<0.05), 건조 방법별 유의한 차이는 없었다고 보고하였다.
미국 식품의약국(FDA, 2024)은 식품에서 히스타민 농도를 2개 이상 샘플에서 50 mg/kg 이상 검출에서 1개 이상의 샘플에서 35 mg/kg 이상 검출로 낮추는 것이 적절하다고 보고하였다. 또한 일반적으로 histamine은 50 mg/kg 미만일 경우 안전한 수준으로 간주되고, 50∼200 mg/kg에서는 잠재적 독성 가능성이 있으며, 200∼1,000 mg/kg에서는 거의 독성을 나타내며, 1,000 mg/kg 이상에서는 독성으로 인하여 식품으로서 안전하지 않은 수준으로 보고된 바 있다(Shalaby, 1996).
과메기 제품의 위생 수준을 평가하기 위해 총호기성균, 대장균군, 대장균의 오염도를 분석하였으며, 그 결과를 Table 2에 제시하였다. 총호기성균의 경우, 손질 청어과메기에서 6.3±1.2 log CFU/g으로 가장 높은 수준을 보였으며, 반손질 청어과메기(5.0±1.0 log CFU/g), 손질 꽁치과메기(3.8±1.4 log CFU/g), 반손질 꽁치과메기(3.7±2.0 log CFU/g)순으로 나타났다.
총 44개의 과메기 제품 중 27개의 제품에서 대장균군이 1.7±0.8 log CFU/g으로 검출되었으며, 대장균은 단 1개의 제품에서 1.8 log CFU/g 검출되었다. 과메기는 원료 어종인 꽁치와 청어의 머리 및 내장 제거 과정에서 대장균군 등 위생지표세균에 오염될 가능성이 있으며, 이후 건조하는 과정에서 온·습도 조건에 따라 미생물의 증식이 일어날 수 있다. 따라서 제품의 제조 단계뿐만 아니라, 작업장 환경에 대한 위생 관리가 중요하다고 판단된다(해양수산부, 2024).
Heu 등(2012)은 시판 청어 과메기 제품에서 총호기성균 및 대장균군이 검출되지 않았다고 보고하였다. 한편, Kim 등(2020)은 온라인 유통 중인 과메기 야채세트의 미생물학적 안전성을 평가한 결과, 과메기에서 총호기성균이 4.1±0.4 log CFU/g, 대장균군이 2.5±0.7 log CFU/g 수준으로 검출되었으며, 대장균은 5개 제품 중 1개 제품에서 1.1±0.0 log CFU/g 검출되었다고 보고하였다.
Ⅳ. 요 약
본 연구는 시중 유통 중인 꽁치 및 청어 과메기의 품질 및 안전성 기준 평가를 위한 기초 자료 마련을 목적으로 하였다. 분석 결과, 수분함량은 원료 어종에 따른 차이를 보여 청어 과메기가 낮았으며, 산가는 원료 어종별, 가공 방법별 차이를 보이지 않았다. 히스타민 함량은 전반적으로 기준치 이내였으나, 일부 시료에서 비교적 높은 값이 확인되어 제조 및 유통 과정 관리의 필요성을 보였다. 미생물학적 품질평가에서도 총균수 및 대장균군 검출 수준이 제품간 차이를 보였으며, 이는 가공 조건 및 위생 관리 수준의 차이에 기인한 것으로 판단된다. 따라서 본 연구 결과는 과메기 품질 및 안전성 관리 기준 마련에 유용한 기초 자료로 활용될 수 있으리라 사료된다.
