Ⅰ. 서 론
세계적으로 인구증가에 따른 식량난과 환경오염에 대한 이슈가 증가하고 있으며, 단백질을 대체할 수 있는 자원의 필요성이 높아지고 있다(Alston et al., 2009). 이에 따라 단백질 공급원으로 콩고기, 배양육, 곤충 등이 대두되고 있고 국제식량농업기구(FAO)에서는 식용곤충을 미래 식량난의 해결방안으로 지목하였다 (Van Huris et al., 2013).
최근 농림축산식품부에서는 축산법 시행규칙 위임 고시인 『가축으로 정하는 기타 동물』을 2023년에 개정하여 갈색거저리, 장수풍뎅이, 흰점박이꽃무지, 누에 유충과 번데기 등의 14종이 가축으로 인정되었다. 그 중 건조한 갈색거저리 유충의 경우 51%의 조단백질을 함유하고 있으며, 제한아미노산이 없어 양질의 단백질을 함유하고 있다(Yi et al., 2013). 영양학적으로 칼슘과 철, 마그네슘 등의 미량영양소가 풍부하며, 비타민 B복합체를 가지고 있고, 키틴질의 식이섬유도 함유하고 있다(Lee et al., 2016).
지금까지 갈색거저리에 대한 선행연구로는 항염증활성(Yu et al., 2016), 항균활성(Chung et al., 1995), 다양한 식품(Jeon and Chung, 2007; Kim et al., 2014; Kim et al., 2015; Min et al., 2016) 등에 첨가한 품질 특성 연구, 항산화 효과(Kim et al., 2015; Yu et al., 2017, Baek et al., 2017) 연구가 진행되었다. 이와 같이 국내에서는 갈색거저리를 이용한 연구가 다수 진행되어 미래식량으로서 활용가치가 뛰어나 최근 식품공전에 등록되었으나, 아직 항산화 기능성 원료, 기능성 식품 첨가물로 활용하기 위한 적정 용매, 추출 조건에 대한 연구가 미비한 실정이다. 따라서 본 연구는 식품산업에서 갈색거저리를 항산화 원료로 활용하기 위하여 탈지 갈색거저리 유충의 에탄올 농도(99%, 50%, 0%)에 따른 추출물의 최대 항산화 기작을 검증하여 최적의 추출조건과 적정용매를 밝히고자 한다.
Ⅱ. 재료 및 방법
전남 생물산업진흥원의 친환경 농생명연구센터에서 탈지된 갈색거저리 유충 분말을 공급받았으며, 유충은 번데기가 되기 전의 노숙유충을 사용하였다. 갈색거저리 유충은 지질함량이 매우 높기 때문에 탈지 공정을 거치지 않으면 분쇄 효율이 떨어져 탈지 공정 후 믹서로 분말화 하였다. 본 실험에 들어가기 전 99%, 75%, 50%, 0% 에탄올로 스크리닝 테스트를 실시하였으며, 테스트 결과 효과가 뛰어난 99%, 50%, 0% 에탄올을 선발하여 본 실험을 진행하였다. 갈색거저리 유충 분말(15 g)을 99%, 50%, 0% 에탄올(150 mL)과 혼합하고, 혼합물을 실온(20±3℃)에서 진탕기를 이용하여 25 rpm으로 16시간 동안 추출하였다. 추출물은 Whatman No. 2 여과지로 여과하였으며, 여과한 추출물을 45℃에서 진공감압농축기(IKA. Ltd, Staufen, Deutschland)를 사용하여 감압농축하였다. 농축추출물은 각각의 용매에 용해하여 원심분리(8,000 rpm, 4℃)를 20분간 실시한 후 4℃, 암실에서 보관하며 실험에 이용하였다.
각 용매에 대한 추출 수율은 감압 농축된 추출물의 무게와 농축 전 갈색거저리 유충 분말의 무게를 측정하여 백분율(%)로 나타내었다(Choe et al., 2011)
총 페놀 함량은 Folin–Ciocalteu 방법을 이용하여 측정하였다(Singleton and Rossi, 1965). 용매 농도에 따른 갈색거저리 유충 추출물 또는 gallic acid(40 μL)를 2 N Folin-Ciocalteu 용액 80 μL 를 혼합하고 3분 동안 혼합하였다. 혼합물에 20% Na2CO3 를 800 μL 넣고 암실에서 37℃, 30분간 반응시켰다. 반응 후 multi-mode 플레이트 리더기(SpectraMax iD3, Molecular Devices, USA)을 이용하여 760 nm에서 흡광도를 측정하였다. Gallic acid(0-150 μg/mL)를 사용하여 시료와 동일한 방법으로 얻은 검량선으로부터 총 페놀 함량을 산출하였다. 총 페놀 함량은 갈색거저리 유충 분말 추출물 g당 mg gallic acid으로 표시하였다.
총 플라보노이드 함량은 Woisky와 Salatino(1998)의 방법을 참고하여 측정하였다. 용매 농도에 따른 갈색거저리 유충 추출물 또는 naringin(100 µL)과 diethylene glycol 1 mL, 1 N NaOH 100 μL를 혼합하여 암실에서 37℃, 1시간 반응시켰다. 반응 후 multi-mode 플레이트 리더기(SpectraMax iD3, Molecular Devices, USA)를 이용하여 420 nm에서 흡광도를 측정하였다. 검량선은 naringin을 사용하여 시료와 동일한 방법으로 얻은 검량선으로부터 총 플라보노이드 함량을 측정하였다.
2,2-diphenyl-1-picrylhydrazyl(DPPH) 라디칼 소거 활성은 Choe et al.(2014)의 방법을 사용하여 측정하였다. 용매 농도에 따른 갈색거저리 유충 추출물 1 mL와 DPPH 용액 1 mL를 혼합하고 어두운 실온에서 30분 동안 반응시켰다. 반응물을 multi-mode 플레이트 리더기(SpectraMax iD3, Molecular Devices, USA)로 517 nm에서 흡광도를 측정하였다. Trolox를 표준물질로 사용하였으며, 시료와 동일한 방법으로 얻은 검량선으로부터 DPPH 라디칼 소거능을 측정하였다. 추출물에 대한 DPPH에 대한 소거능(IC50)은 용매만을 사용한 대조군의 흡광도를 50% 감소시키는데 필요한 농도로 나타내었다.
다음 식에 따라 계산하였다:
환원력은 Dudonné 등(2009)과 Luqman 등(2012)의 방법을 이용하여 측정하였다. 0.3 M sodium acetate buffer와 20 mM FeCl3, 40 mM HCl에 녹인 10 mM TPTZ를 10:1:1의 비율로 섞고, 37℃에서 15분 이상 반응시켜 준비하였다. 용매 농도에 따른 갈색거저리 유충 추출물 1 mL와 FRAP 시약 3 mL 를 혼합하고, 암실에서 37℃, 15분간 반응시켰다. Multi-mode 플레이트 리더기(SpectraMax iD3, Molecular Devices, USA)를 이용하여 593 nm에서 흡광도를 측정하였으며, Trolox를 표준물질로 사용하여 시료와 동일한 방법으로 얻은 검량선으로부터 환원력을 측정하였다.
2,2-Azinobis-3-ethylbenzo thiazoline-6-sulfonic acid(ABTS) 라디칼 소거능은 Re 등(1999)의 방법을 변형하여 측정하였다. 14 mM ABTS와 4.9 mM potassiun persulfate를 1:1로 섞어 24시간 동안 암실에서 방치하여 radical 생성을 유도하였다. 그 후 multi-mode 플레이트 리더기(SpectraMax iD3, Molecular Devices, USA)를 사용하여 734 nm에서 흡광도 값이 0.70±0.02 정도가 되도록 에탄올로 희석하여 사용하였다. ABTS+ 라디칼 용액 3 mL와 용매 농도에 따른 갈색거저리 유충 추출물 20 μL를 혼합하여 실온 어두운 곳에서 5분간 반응시켰다. 반응 후 multi-mode microplate reader(SpectraMax iD3, Molecular Devices, USA)를 사용하여 734 nm에서 흡광도를 측정하였으며, Trolox를 표준물질로 사용하여 시료와 동일한 방법으로 얻은 검량선으로부터 ABTS+ 라디칼 소거능을 측정하였다.
철 이온 킬레이트 활성은 Decher와 Welch(1990)의 방법을 이용하여 측정하였다. 용매 농도에 따른 갈색거저리 유충 추출물(500 µL)와 2 mM FeCl2(50 µL)를 혼합하고 5분 반응 후 5 mM ferrozine solution(100 µL)를 첨가하여 실온 암실에서 10분간 반응시켰다. 반응 후 multi-mode microplate reader(SpectraMax iD3, Molecular Devices, USA)를 사용하여 562 nm에서 흡광도를 측정하였으며, EDTA를 표준물질로 사용하여 시료와 동일한 방법으로 얻은 검량선으로부터 Fe2+ 킬레이트 활성을 측정하였다.
Ⅲ. 통계분석
본 연구의 모든 실험 결과는 최소 3회 이상의 반복 실험하여 평가하였다. 이후 통계프로그램 SAS (version 9.3 for window, SAS Institue, USA)를 사용하여 평균값과 표준편차로 결과를 나타내었으며, 분산분석(ANOVA)에서 던컨시험(Duncan’s multiple range test)을 이용하여 각 평균의 유의차가 있는지 95% 수준에서 검증하였다.
Ⅳ. 결과 및 고찰
추출용매는 종류, 온도, 시간 등에 따라 추출되는 물질이 다르며, 이는 추출수율에 영향을 줄 수 있다(Kim et al., 1995). 본 실험에서의 추출수율 결과를 Table 1에 나타내었다. 갈색거저리 추출물의 99% 에탄올 추출 수율은 29.59%였고, 50% 에탄올 추출 수율은 33.66%, DW 추출 수율은 30.16%로 측정되었으며, 50% 에탄올 추출 수율이 유의적으로 가장 높았다(p<0.05). 이는 갈색콩(Lee et al., 2016)과 양파껍질(Shim et al., 2012)에서 물과 에탄올 홉합용매가 더 높은 추출 수율을 나타내었다고 보고한 결과와 일치하였다. 이러한 결과는 50% 에탄올 추출 조건이 다른 조건에 비해 수용성 및 지용성 성분의 추출을 더욱 수월하게 해주었고, 이에 따라 추출 수율이 더욱 높은 것으로 사료된다.
페놀, 플라보노이드 화합물은 항균활성, 항암, 항노화 활성뿐만 아니라, 항알러지, 혈당 저하 등의 효과가 있다고 알려져 있다(Duval et al., 1999; Stevenson et al., 1993). 페놀 화합물 함량 측정한 결과를 Table 1에 나타내었다. 연구결과는 모든 추출 조건을 포함하였을 때 2.32∼2.52 mg/g였다. 50% 에탄올에서 2.52 mg/g의 페놀 화합물을 함유하고 있는 것으로 나타났지만 유의적인 차이는 없었다. Park(2019)의 연구에 따르면 새싹인삼의 페놀함량을 조사한 결과는 4 mg/g으로 측정되었으며, 갈색거저리 유충에서도 50% 에탄올 추출 조건에서 2.52 mg/g 수준의 총 페놀을 추출할 수 있었으므로, 항산화 성분이 뛰어난 다른 식품 소재에 준하는 수준의 기능성 소재로서의 활용 가치가 있다고 판단된다.
Flavonols, flavones, catechins, isoflavones 등은 플라보노이드류 화학구조에 따라 분류되며, 물과 에탄올에 대한 용해도가 다르다. 과산화 지질 생성억제 등의 생화학적 활성은 구조적 차이에 의해 일어나는 것으로 알려져 있다(Middleton and Kandaswami, 1994). 총 플라보노이드 함량 측정결과를 Table 1에 나타내었다. 본 실험 결과, 갈색거저리 유충의 플라보노이드 함량은 0.66∼1.27 mg/g을 함유하는 것으로 측정되었다. 99% 에탄올과 0% 에탄올(DW)에서 추출한 플라보노이드 함량이 50% 에탄올보다 유의적으로 높았다(p<0.05). 다음과 같은 결과는 용매에 의하여 용해된 성분들이 추출절차, 추출조건 등에 의하여 영향을 받기 때문인 것으로 사료된다(Meyer et al., 1998).
DPPH라디칼은 항산화 물질이 수소원자나 전자를 공여할 수 있는 능력을 평가하는 물질로서 수소원자나 전자를 받아 안정된 화합물로 전환되어 보라색을 띄는 라디칼이 옅은 노란색으로 변한다(Bondet et al., 1997). Table 1은 갈색거저리의 용매별 추출물의 DPPH 라디칼 소거 활성을 측정하여 50%라디칼 저해율을 나타내는 IC50값으로 나타내었다. IC50값은 99% 에탄올 추출물에서 0.82 mg/g, 50% 에탄올 추출물에서 0.75 mg/g, 0% 에탄올(DW) 추출물에서 0.72 mg/g으로 측정되었고, 99% 에탄올 추출물에서 가장 높았다. Yu 등(2017)의 연구에서 갈색거저리 유충 단백가수분해물의 DPPH를 측정한 결과, RC50값이 328.07∼405.81 µg/mL로 측정되어 본 연구와 유사하였다.
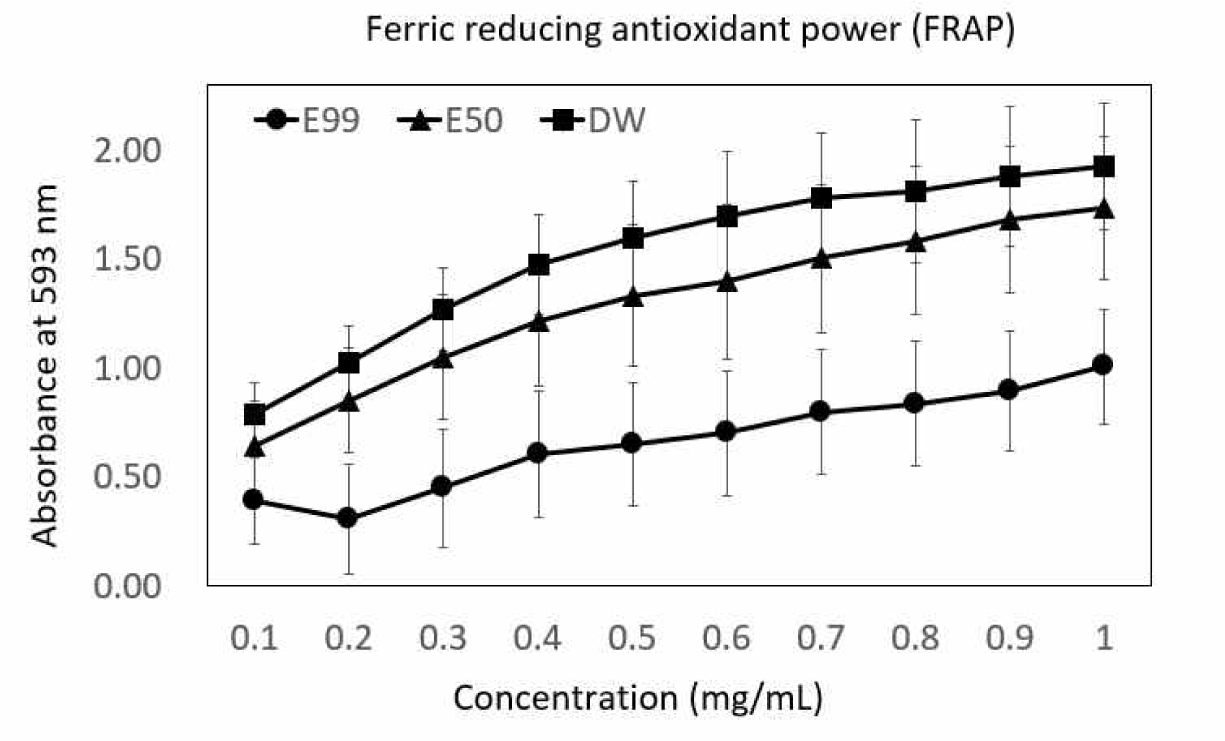
Ferric reducing antioxidant power는 2가 철을 3가 철로 환원시키는 능력으로 FRAP assay에서 흡광도 수치는 시료의 환원력을 나타내고, 높은 항산화 활성을 가질수록 높게 측정된다. 용매별 갈색거저리 유충의 Ferric reducing antioxidant power 측정결과를 Fig. 1에 나타내었다. 99% 에탄올 추출물의 흡광도는 0.391∼1.006, 50% 에탄올 추출물의 흡광도는 0.639-1.738, 0% 에탄올 추출물(DW)의 흡광도는 0.787∼1.925를 나타내어 50% 에탄올 추출물과 0% 에탄올 추출물(DW)에서 유의적으로 높은 항산화 활성을 나타내었다. Santas 등(2008)에 따르면 페놀화합물의 함량이 높을수록 항산화 활성이 우수하였다고 보고하였으며, 갈색거저리 유충 또한 높은 페놀화합물 함량에 의하여 항산화 활성이 높게 측정된 것이라고 생각된다.
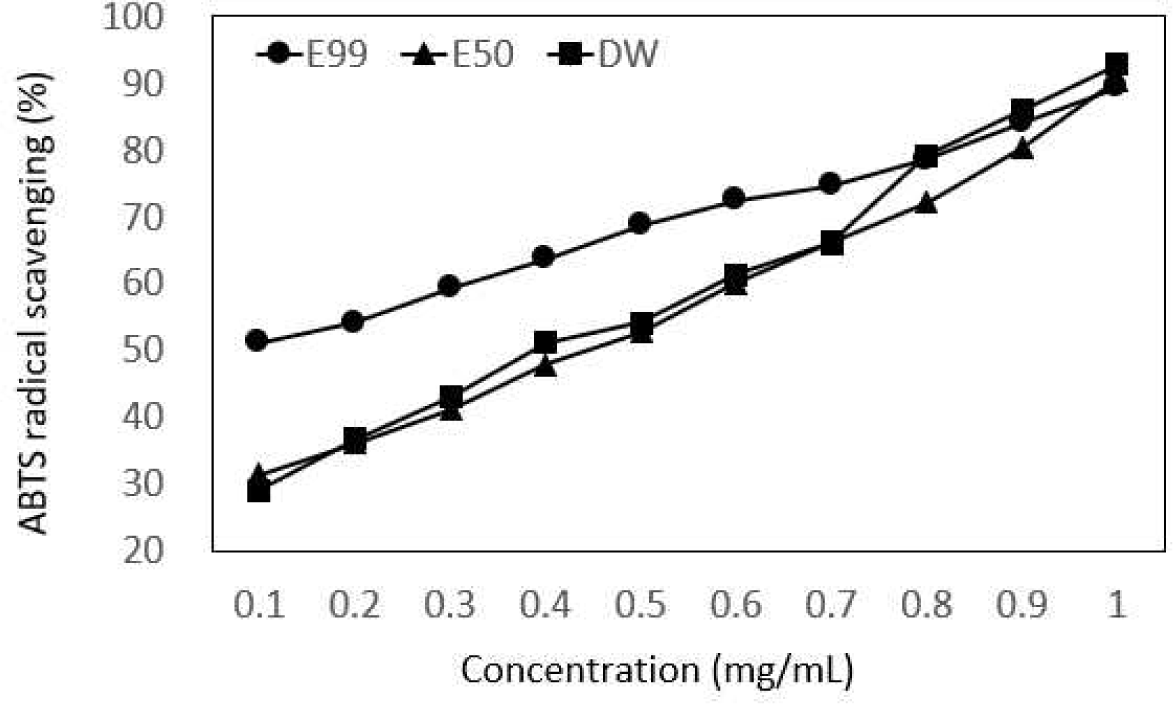
실험 전 potassium persulfate와 미리 하루 정도 반응시켜 청록색의 라디칼을 생성해야 한다. Hydrogen donating antioxidant와 chain breaking antioxidant 모두 측정할 수 있으며, 시료를 첨가하면 연한 하늘색으로 변하는 것을 측정하는 방법이다. 갈색거저리 유충의 Free radical 저해능을 Fig. 2에 나타내었다. 99% 에탄올 추출물은 51.15∼89.32%, 50% 에탄올 추출물은 31.45∼90.51%, 0% 에탄올 추출물(DW)는 29.10∼92.81%로 나타났다. 0% 에탄올 추출물(DW)에서 갈색거저리 유충의 함량이 높아질수록 Free radical 저해율이 급격하게 증가하였다. 폴리페놀 성분이 함유된 아보카도 메탄올 추출물 200 μg/mL에서 38.4%의 저해율을 보인 연구(Lee et al., 2007)보다 갈색거저리 유충의 소거 활성이 더 우수한 것으로 판단된다.
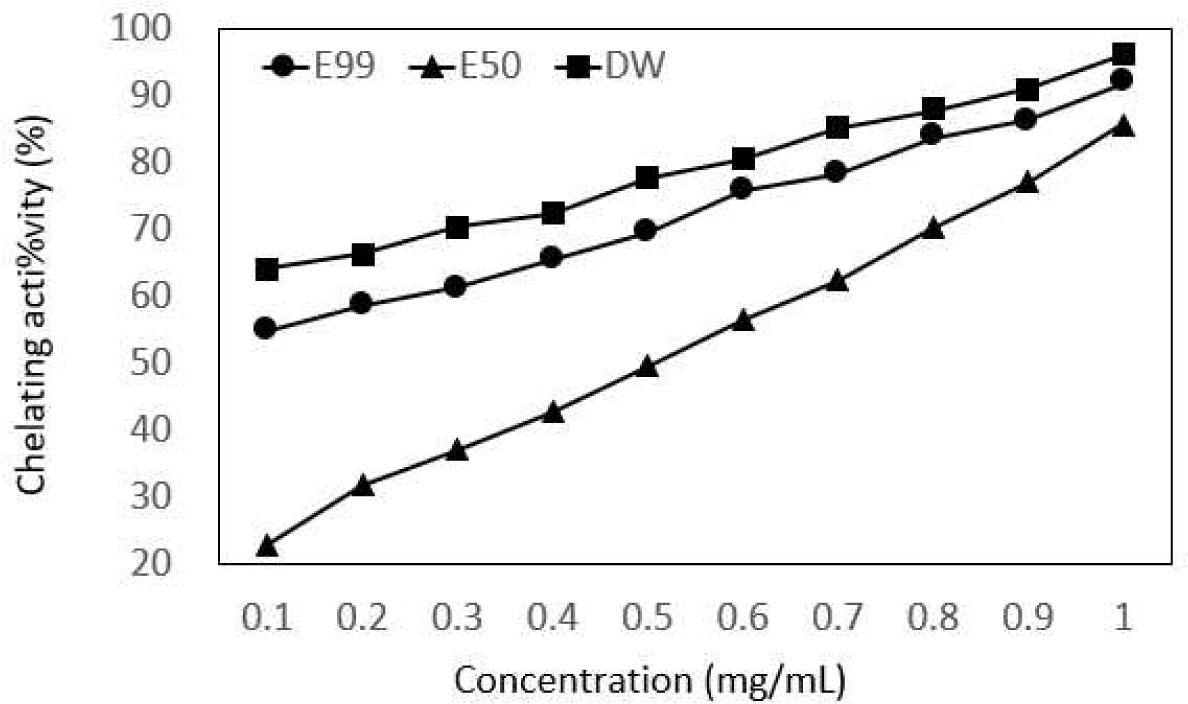
EDTA와 같은 금속 chelate 화합물을 첨가하면 Co, Cu, Fe, Mn, Ni 등과 같은 금속을 chelate하여 금속 촉매제로 인한 자유 라디칼의 생성을 막아 산화를 방지하는 작용을 한다(Cho et al., 1989). 99% 에탄올 추출물은 54.91∼91.75%, 50% 에탄올 추출물은 22.82∼85.67%, 0% 에탄올 추출물(DW)는 64.16∼96.13%로 나타났다(Fig. 3). Lee 등(2007)의 연구에서 DPPH 라디칼 소거능은 에탄올추출물에서 높았고, Fe2+ chelating activity은 물 추출물에서 높게 측정되어 본 연구와 일치하였다. 항산화 작용은 라디칼 소거, 금속의 chelating activity, 과산화물의 분해와 같은 반응이 복합적으로 작용하기 때문이라고 생각된다.
Ⅴ. 요 약
본 연구는 탈지 갈색거저리 유충의 에탄올 농도(99%, 50%, 0%)에 따른 추출물의 최대 항산화 기작을 검증하여 최적의 추출조건과 적정용매를 밝히고자 실시하였다. 갈색거저리 유충의 추출물은 감압농축하여 용매에 녹여 실험에 사용하였으며, 추출수율, 총 페놀함량, 총 플라보노이드 함량, DPPH 라디칼 소거능, 환원력(FRAP), ABTS+ 라디칼 소거능, Fe2+ 킬레이트 활성을 분석하였다. 추출수율은 50% 에탄올에서 유의적으로 가장 높은 수율을 나타내었다(p<0.05). 0% 에탄올 (DW) 추출물에서 50% 에탄올 추출물보다 유의적으로 높은 총 플라보노이드 함량, 환원력, ABTS+ 라디칼 소거능, Fe2+ 킬레이트 활성을 나타내었다(p<0.05). 본 연구결과를 바탕으로 탈지 갈색거저리 유충의 최대 항산화능을 나타내는 적정 용매 농도는 0% 에탄올(DW)이며, 추후 높은 항산화능을 가진 단백질원으로서 활용이 가능할 것으로 사료된다. 추후 갈색거저리의 식품산업적 활용을 위하여 추가적인 다양한 용매 또는 항산화 성분의 정성 및 정량적으로 평가하는 연구가 필요할 것으로 생각된다.
