Ⅰ. 서 론
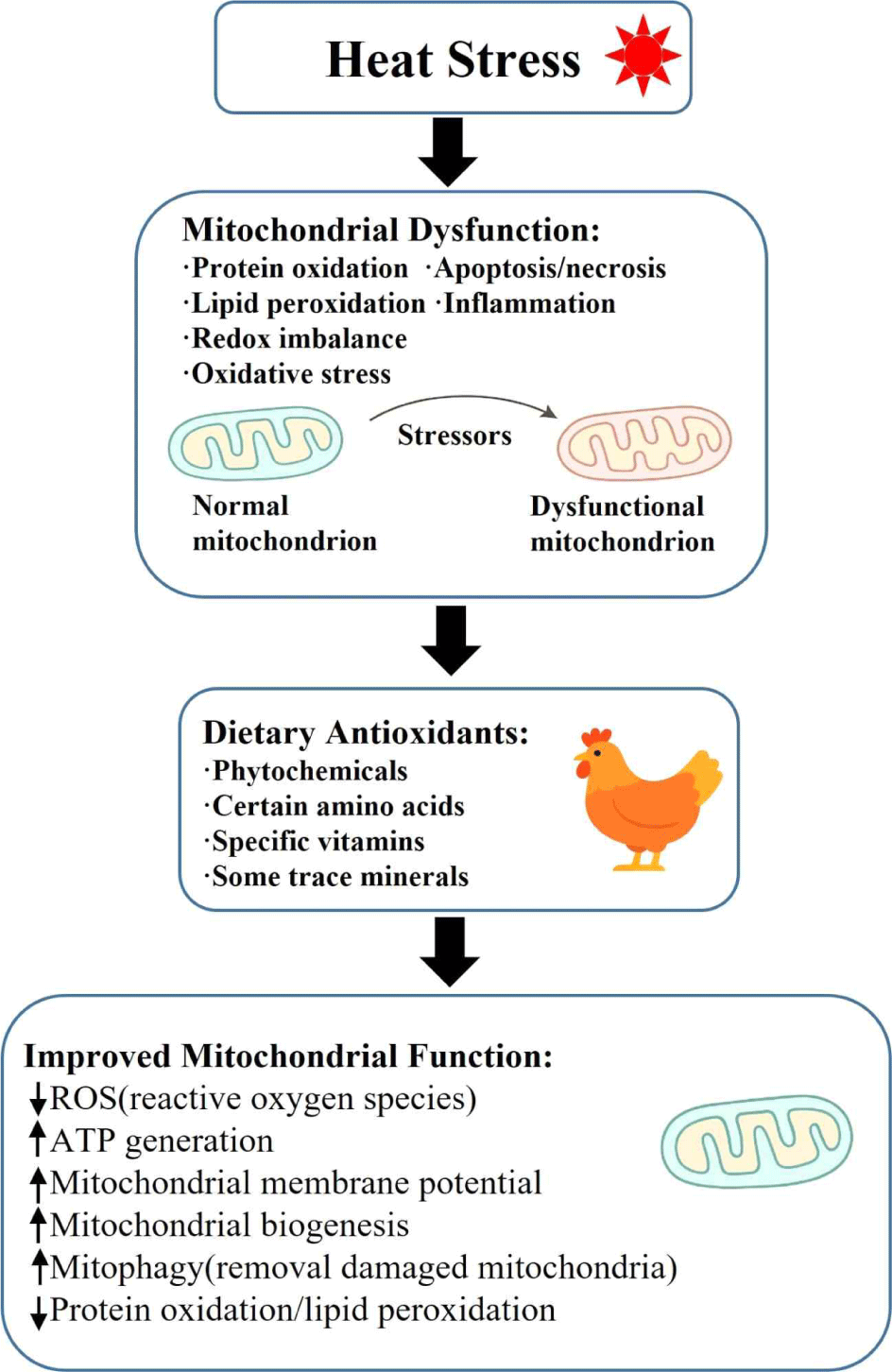
지구 온난화는 현대 축산업에 중대한 도전 과제로 부상하고 있으며, 환경 온도의 상승은 가축 생산성에 부정적인 영향을 미친다. 특히 가금류는 높은 대사율과 제한적인 체온 조절 능력으로 인해 열 스트레스에 취약하다(Liu et al., 2020; Pawar et al., 2016). 폭염의 빈도와 강도가 증가하면서 이러한 문제는 더욱 심화되고 있으며, 전 세계 가금류 산업에 심각한 경제적 손실을 초래하고 있다. 일반적으로 육계의 최적 성장 온도는 18~22℃ 범위로 알려져 있으며, 이 범위를 초과하는 온도는 열 스트레스를 유발할 수 있다(Sahin et al., 2006). 닭은 환경 온도에 따라 쾌적 구역(comfort zone), 임계 구역(critical zone), 상한 임계 구역(upper critical zone)에 노출될 수 있다. 쾌적 구역(18∼25℃)에서는 최소한의 생리적 조절만으로 정상적인 체온 유지를 할 수 있다. 그러나 임계 구역(26∼35℃)에서는 체온 유지를 위해 물리적인 열 조절 기전(예: 호흡수 증가, 날개 벌리기 등)이 요구된다. 상한 임계 구역(35℃ 초과)에서는 체내 발생한 열을 효과적으로 방출하지 못하게 되며, 이로 인해 생리적 이상과 여러 장기의 기능 장애가 초래되며, 심한 경우 폐사로 이어질 수 있다(Sohail et al., 2012). 열 스트레스는 육계의 성장률, 사료 이용 효율, 폐사율 상승 등 전반적인 생산성 감소뿐만 아니라 면역 기능 저하, 산화 스트레스 및 염증 반응을 유발하여 건강을 더욱 악화시킨다(Belhadj Slimen et al., 2016; Huang et al., 2015; Lara and Rostagno, 2013). 열 스트레스는 특히 미토콘드리아 기능에 심각한 손상을 일으킨다. 미토콘드리아는 에너지 생산, 활성산소 조절, 세포 신호전달에 중심적인 역할을 담당하지만, 스트레스 환경에서는 ATP 생성 저하, 활성산소종(ROS, reactive oxygen species) 축적, 세포 자가사멸(apoptosis) 촉진 등 기능 장애가 나타난다(Jastrebski et al., 2017). 이러한 변화는 근육 발달 저해와 육질 저하뿐 아니라 면역력 약화로 이어져 다양한 질병에 취약해지는 원인이 된다(Rostagno, 2020; Zhang et al., 2012). 따라서 열 스트레스가 미토콘드리아 기능에 미치는 영향을 이해하는 것은 육계 산업에서 효과적인 스트레스 완화 전략을 개발하는 데 필수적이다. 본 논문에서는 열 스트레스와 미토콘드리아 기능 장애 간의 관계를 고찰하고, 미토콘드리아 기능 개선을 위한 기능성 물질의 적용 가능성을 탐색하고자 한다.
Ⅱ. 본 론
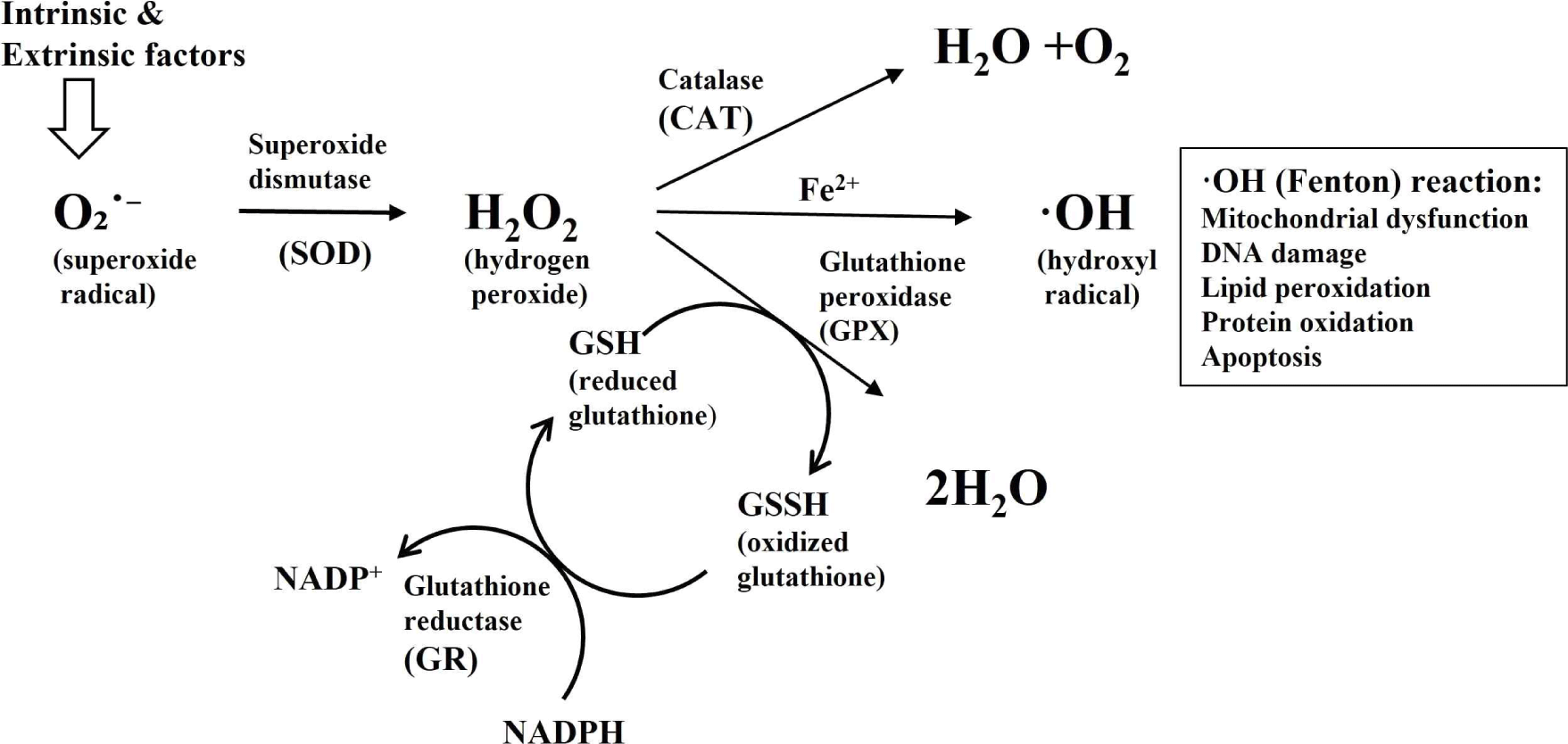
미토콘드리아는 진핵세포에서 에너지 생산뿐 아니라 스트레스 반응과 신호 전달에서도 핵심적인 역할을 한다. 스트레스 반응과 신호 전달에서, 미토콘드리아는 내적 및 외적 스트레스에 반응하여 세포 내 및 원거리 세포와 조직에 대사 신호를 전달함으로써 세포 및 유기체의 기능을 변화시키는데, 이는 세포 항상성 유지와 스트레스 대응에 중요한 역할을 한다(Suomalaine and Nunnari, 2024). 스트레스 반응에서 미토콘드리아는 ROS를 생성하고 이를 조절한다. ROS는 산화적 인산화 과정에서 흔히 생성되는 부산물이다. 이들의 조절은 DNA, 단백질, 그리고 지질에 산화적 손상을 유발할 가능성이 있기 때문에 중요하다. 또한, ROS는 근육 성장, 줄기세포 분화, 적혈구 성숙과 같은 세포 상태를 조절하는 신호 분자로도 작용한다(Ahlqvist et al., 2015). 미토콘드리아는 여러 가지 기작을 통해 ROS를 생성하는데, 그중 미토콘드리아 복합체 I과 III가 주요 ROS 생성자로 작용한다. 이들은 초과산화물(O2-)을 생성하며, 이는 물(H2O)과 반응하여 과산화수소(H2O2)를 형성한다(Murphy, 2009). 적절한 수준의 ROS는 세포 신호 전달에 중요한 역할을 하지만, 과도한 ROS 축적은 세포 손상을 유발할 수 있다. 따라서 미토콘드리아는 세포 내 항산화 효소들에 의해 ROS의 생성과 제거를 조절하여 산화 스트레스에 대응한다(Fig. 1). 미토콘드리아는 세포 자가사멸 경로의 핵심 조절자로 작용한다. 미토콘드리아 기능 장애는 역방향 신호 전달(retrograde signaling)을 통해 단계적으로 진행되는 스트레스 반응을 유도한다(Hill and Remmen, 2014). 이 반응에는 손상을 복구하기 위한 대사 경로의 재구성부터, 미세자식(microautophagy: lysosome에 의해 짧은 수명을 가진 손상된 미토콘드리아의 일부분을 제거하는 과정), 미토파지(mitophagy: 손상되거나 노화된 전체 미토콘드리아를 선택적으로 제거하는 자가포식 과정), 그리고 미토콘드리아 유래 소포(vesicle)-매개 경로를 통한 손상된 단백질 제거까지 포함된다(Konig and McBride, 2024). 이러한 경로가 과부하되면, 세포는 신호 및 조직 환경에 따라 세포 자가사멸을 유도한다. 즉, 세포가 심각한 스트레스에 노출되면, 미토콘드리아는 시토크롬 c와 같은 단백질을 방출하여 자가사멸 신호를 활성화한다(Suomalaine and Nunnari, 2024). 이를 통해 손상된 세포를 제거하고 조직의 건강을 유지한다. 미토콘드리아 기질(matrix) 내의 칼슘 이온(Ca2+)은 시트르산 회로에서 세 가지 속도 제한 효소(rate-limiting enzymes)를 조절하여 산화 대사를 촉진하는 데 필수적이다. 이 효소에는 이소시트르산 탈수소효소(isocitrate dehydrogenase), α-케토글루타르산 탈수소효소(α-ketoglutarate dehydrogenase), 피루브산 탈수소효소(pyruvate dehydrogenase)가 포함된다(Bernardi et al., 2022). 칼슘 이온은 NADH 및 FADH2와 같은 산화적 인산화의 환원 기질(reduced oxidative phosphorylation substrates) 합성을 촉진하는 역할을 한다(Mammucari et al., 2018). 생리적으로, 미토콘드리아 내 Ca2+ 축적은 세포 스트레스에 대한 반응으로 미토콘드리아의 생체 에너지 생성 및 세포 과정(cellular processes)을 향상시키는 데 필요하다. 미토콘드리아는 세포 내 Ca2+의 농도를 조절하여 다양한 신호 전달 경로를 조율한다. 칼슘 이온은 근육 수축, 신경 전달, 호르몬 분비 등 여러 생리적 과정에 관여하며, 미토콘드리아는 이러한 칼슘 신호를 흡수하고 방출함으로써 세포 기능을 조절한다(Zhang et al., 2021). 마지막으로 대사 산물 및 에너지 상태 전달 기능에서 미토콘드리아는 ATP 생산을 통해 세포의 에너지 상태를 감지하고, 이를 다른 세포 소기관과 공유한다. 이러한 에너지 신호는 세포 성장, 분화, 대사 조절 등 다양한 과정에 영향을 미친다(Monzel et al., 2023; Suomalaine and Nunnari, 2024). 이처럼 미토콘드리아는 스트레스 반응과 신호 전달의 중심에서 세포의 생존과 기능을 조절하는 중요한 역할을 수행한다.
미토콘드리아는 독자적인 유전자를 보유할 뿐 아니라, 그 기능과 스트레스 반응을 조절하는 여러 핵 유전자들도 존재한다. 이들은 미토콘드리아 단백질 품질 관리, 대사 조절, 손상된 미토콘드리아 제거, 항산화 반응 조절 등에 핵심적인 역할을 한다. 미토콘드리아 DNA에는 전자전달계 복합체의 핵심 단백질들을 암호화하는 유전자들이 포함되어 있다. 대표적으로 MT-ND (mitochondrially encoded NADH dehydrogenase) 유전자군은 NADH 탈수소효소(복합체 I)의 일부를 구성하는 7개의 소단위체 유전자를 포함한다(Hirst, 2013; Suomalainen and Nunnari, 2024). 이들은 전자전달계의 첫 번째 단계에 관여하며, 기능 이상 시 ROS 생성이 증가할 수 있다(Szczepanowska et al., 2020). ROS 축적과 단백질 접힘 이상은 미토콘드리아 단백질 스트레스 반응(UPRmt, mitochondrial unfolded protein response)을 유도할 수 있다. 또한, MT-COX (mitochondrially encoded cytochrome c oxidase subunit) 유전자군(COX1, COX2, COX3)은 시토크롬 c 산화효소(복합체 IV)의 구성 요소로, 전자전달계의 마지막 단계에서 산소를 전자 수용체로 환원시켜 ATP 합성을 마무리한다(Fontanesi et al., 2006). MT-CYB (mitochondrially encoded cytochrome b) 유전자는 복합체 III의 주요 구성 요소인 시토크롬 b 단백질을 암호화하며, 전자 전달 및 양성자(H+) 구동력 형성에 관여한다. HSP60과 HSP10은 미토콘드리아 내 샤페론 단백질로, 단백질 접힘 유지와 손상 단백질 제거에 관여한다(Bottinger et al., 2015). 이들은 열 스트레스 및 미토콘드리아 내 단백질 품질 저하 상황에서 발현이 증가하며, UPRmt의 활성화를 유도한다(Suomalaine and Nunnari, 2024). SIRT3와 SIRT5는 미토콘드리아 내에서 작용하는 탈아세틸화 효소로, 세포 대사 조절 및 항산화 방어 반응에 핵심적인 역할을 한다(Singh et al., 2018). 산화 스트레스 환경에서 이들의 활성화는 ROS를 감소시키고, 미토콘드리아 기능을 보호하는 데 기여한다. PINK1과 PARKIN은 손상된 미토콘드리아를 제거하는 미토파지를 조절하는 주요 인자이다. 미토콘드리아 손상 시, PINK1이 축적되어 PARKIN을 활성화하고, 손상된 미토콘드리아의 제거를 촉진한다(Salazar et al., 2018; Suomalaine and Nunnari, 2024). 이는 HSP 단백질들과 함께 미토콘드리아 품질 유지에 필수적인 메커니즘이다. 또한, NRF2는 항산화 유전자 및 미토콘드리아 스트레스 반응 유전자의 전사를 조절하는 핵심 전사인자로, 산화 스트레스 상황에서 활성화되어 세포를 ROS로부터 보호한다(Georges et al., 2025; Kouvedaki et al., 2024). 미토콘드리아는 산화적 인산화를 통해 세포에 필요한 ATP의 최대 90%를 생산하는 에너지 중심 기관이다(Li et al., 2019). 시토크롬 c 산화효소는 전자전달계의 마지막 효소 복합체로, 환원된 시토크롬 c로부터 산소로의 전자 전달을 담당하며, 이는 ATP 생산에 직접 연결된다(Dhar and Wong-Riley, 2009; Zhang et al., 2016). 이 외에도, 미토콘드리아는 세포 내 Ca2+ 대사, 세포 사멸 조절, 생식세포 형성과 같은 다양한 생리 기능에 관여한다(Uyanga et al., 2022; Zhang et al., 2016). 특히, 열 스트레스와 같은 급성 환경 변화는 미토콘드리아 단백질 손상을 유발하며, 세포호흡 사슬 효소 활성과 미토콘드리아 생합성을 자극할 수 있다(Liu and Brooks 2012). 따라서 시토크롬 c 산화효소 단백질의 양과 활성은 동물 모델에서 미토콘드리아 기능의 지표로 활용될 수 있다(Uyanga et al., 2022).
열 스트레스는 세포 내 단백질 산화를 유도하고, 이는 ROS의 과도한 생성과 미토콘드리아 기능 저하로 이어지며, 결과적으로 미토콘드리아 손상을 초래할 수 있다. 단백질 카르보닐화(protein carbonylation)는 ROS에 의해 단백질의 곁사슬 아미노산이 산화되어 케톤(C=O) 또는 알데하이드(CHO)기가 도입되는 과정으로, 산화 스트레스에 의해 유도된 단백질 손상을 나타내는 대표적인 바이오마커이다(Bozaykut et al., 2013). 여러 연구에 따르면, 열 스트레스는 가금류에서 단백질 산화의 주요 원인으로 작용한다. Tan 등(2010)은 고온(23∼38℃, RH 70%) 조건에서 사육된 육계의 간 조직에서 단백질 카르보닐 수치가 대조군(25℃)보다 유의하게 증가한다고 보고하였다. Liao 등(2022)은 열 스트레스가 육계의 미토콘드리아와 근육 조직 모두에서 단백질 산화를 촉진한다고 보고하였다. Zhang 등(2022)은 간 조직 및 배아 간세포에서 단백질 카르보닐 수치가 증가함을 확인하였으며, 이는 열 스트레스 조건에서의 산화적 손상을 지지하는 결과이다. Bai 등(2023)은 순환적 열 스트레스(8시간 34℃, 16시간 24℃)가 간 내 항산화 효소인 superoxide dismutase(SOD), 총 항산화능(TAC, total antioxidant capacity), glutathione peroxidase(GPX)의 활성을 감소시킨다고 보고하여, 열 스트레스의 항산화 방어 체계 억제를 입증하였다. 이러한 결과는 열 스트레스가 가금류에서 단백질 산화와 관련된 생리적 변화를 유도하며, 이와 관련된 단백질체학적 변화 및 완화 전략에 대한 추가 연구의 필요성을 강조한다.
지질, 특히 다가불포화 지방산(PUFAs, polyunsaturated fatty acids)은 산화 스트레스에 가장 취약한 생체분자 중 하나이다. PUFAs는 ROS와 반응하면서 수소를 잃고 불안정한 지질 라디칼( L•, lipid radical)을 형성한다. 이후 산소 분자가 결합하면서 지질 퍼옥실 라디칼(LOO•, lipid peroxyl radical)이 생성되고, 이는 연쇄적인 라디칼 반응을 통해 또 다른 지질로부터 수소를 제거함으로써 지질 하이드로퍼옥사이드(LOOHs, lipid hydroperoxides)를 형성하게 된다(Ayala et al., 2014). 이 과정을 지질 과산화(lipid peroxidation)라 하며, 그 산물로는 말론디알데하이드(MDA, malondialdehyde)와 같은 반응성 알데하이드가 포함된다. MDA는 지질 과산화의 대표적인 2차 산화 생성물로, ROS에 의해 세포막의 불포화 지방산이 산화될 때 형성된다. 세포막 손상의 주요 지표로 간주되며, 산화 스트레스 수준을 간접적으로 평가할 수 있는 생체 지표로 널리 활용된다(Cordiano et al., 2023). MDA는 혈액, 간, 근육, 소변 등 다양한 조직과 체액에서 검출 가능하며, 산화적 손상이 수반되는 동물 모델(예: 열 스트레스, 노화, 대사 질환 등)에서 유용하게 사용된다. 여러 연구에 따르면, 열 스트레스는 육계에서 MDA 농도의 유의한 증가를 유발하며 이는 지질 과산화의 상승과 밀접하게 관련된다. 예를 들어, Tan 등(2010)은 고온 환경(RH =70%에서 23∼38℃)에서 사육된 육계의 간 조직에서 MDA 수치가 대조군(25℃)에 비해 현저히 증가했다고 보고하였다. 유사하게, Lu 등(2017)은 32℃ 조건에서 7일간 사육된 육계의 가슴 근육에서, Wang 등(2019)은 36±2℃에서 반복적으로 열 스트레스를 받은 육계의 간 조직에서 MDA 수치가 증가하였다고 보고하였다. 또한, Ouyang 등(2022)은 혈청, 간, 회장 조직에서 MDA 농도가 최소 12.5%에서 최대 40%까지 상승하였으며, Deng 등(2023)은 35±2℃ 조건에서 사육된 육계의 MDA 수치가 대조군 대비 약 20% 증가했다고 밝혔다. Bai 등(2023)은 순환 열 스트레스(8시간 34℃, 16시간 24℃)가 간 조직의 MDA 수치를 유의하게 상승시킨다고 보고하였다. 이러한 결과들은 열 스트레스가 지질 과산화를 유도하며, 이는 세포막 구조 손상 및 기능 이상으로 이어질 수 있음을 시사한다. 따라서 MDA는 육계에서 열 스트레스에 따른 산화적 손상을 모니터링하고, 항산화 전략의 효과를 평가하는 데 핵심적인 바이오마커로 간주된다.
앞에서 언급한 것처럼, ROS는 산화적 인산화 과정 특히 미토콘드리아 복합체 I과 III가 주요 ROS 생성자이다. 세포에서 과도한 ROS 축적은 세포 손상을 유발할 수 있다. 열 스트레스는 높은 ROS를 생성하여 동물의 항산화 시스템을 비활성화한다(Abd El-Hack et al., 2020). Yang 등(2010)의 급성 스트레스에 노출된 육계에 대한 결과는 급성 열 스트레스가 현저한 ROS 방출을 시작한다는 것을 밝혔다. 20일 동안 고온(34℃±8시간 동안 1℃, 나머지 시간 동안 22±1℃)에 노출된 육계는 ROS에서 상당한 상승을 보였다. 그 결과, 간세포의 미토콘드리아 막 전위(MMP, mitochondrial membrane potential)가 크게 감소했다(Zhang et al., 2018a). 열 스트레스(7일, 32℃)에 노출된 육계는 대조군에 비해 가슴 근육에서 더 높은 ROS 값을 보였다(Lu et al., 2017). 또한, 열 스트레스(36±2℃)에 1~2주 동안 지속적으로 노출된 육계는 대조군(25±2℃)보다 ROS 값이 상승하였다(Wang et al., 2019). 따라서, 항산화 효소를 활성화하고 지질산화효소(lipoxygenase) 및 NADPH 산화효소(NADPH oxidase)와 같은 산화 촉진 효소를 억제하여 ROS로 인한 산화적 손상을 개선할 수 있는 전략이 요구된다.
미토콘드리아의 산화 환원 균형/항상성(redox homeostasis)은 세포 생존, 에너지 생성, 그리고 산화 스트레스 조절에 있어 핵심적인 역할을 수행한다. 특히 항온성 동물이지만 체온조절 능력이 제한적인 육계는 환경 온도 변화에 민감하여, 열 스트레스에 노출될 경우 대사율 변화, 면역 기능 저하, 그리고 산화 환원 균형의 붕괴가 발생하며, 이는 결국 미토콘드리아 기능 이상으로 이어진다. 열 스트레스는 미토콘드리아 내 ROS의 과잉 생산을 유도하여 산화적 손상을 초래하고, 그 결과로 항산화 방어 시스템의 효율이 저하된다. 미토콘드리아는 ROS의 주요 생성원인 동시에 ROS를 해독하는 핵심 장기로, glutathion/glutaredoxins(GSH/Grx) 시스템과 thioredoxin /peroxiredoxin(Trx/Prx) 시스템을 통해 세포를 산화 손상으로부터 보호한다(Fig. 1). 스트레스 요인에 대응하기 위한 방법으로 육계 사료에 천연 항산화제를 사용하면 항산화제가 다양한 유전자의 발현에 영향을 미친다. 특히 산화 환원 항상성을 조절하는 Nrf(nuclear factor erythroid related factor)2가 SOD, Heme Oxygenase-1(HO-1), GSH등의 유전자를 조절하는 대표적 전사인자로 알려져 있다(Kouvedaki et al., 2024). Zhang 등(2018b)은 열 스트레스에 노출된 육계에서 간 미토콘드리아 내 GSH 수치가 크게 감소하고, Nrf2 경로 활성 저하로 인해 항산화 반응이 약화된다고 보고하였다. 미토콘드리아의 내인성 항산화 시스템은 주로 Trx/Prx 및 GSH/Grx 경로에 의존하며, Trx/Prx 시스템은 Trx2, Prx3 및 Thioredoxin reductase(TrxR)2로 구성되어 ROS에 의한 과산화물 및 과산화수소를 제거하는 1차 방어선 역할을 한다(Patenaude et al., 2004). Perez 등(2008)의 연구에서는 Trx2의 과발현이 산화 스트레스 조건에서 미토콘드리아 기능 보호에 직접적으로 관여함을 확인하였다. Zhang 등(2018a)은 열 스트레스가 육계의 Prx3, Trx2, TrxR2 유전자의 발현을 억제한다고 보고하였으며, 이는 미토콘드리아의 항산화 방어 약화를 시사한다. 또한 Ouyang 등(2022)은 열 스트레스를 받은 육계의 간 및 회장 조직에서 GSH, catalase(CAT), SOD, TAC이 모두 감소했다고 보고하였다. 간 조직에서 HO-1, NQO1 (NAD(P)H: Quinone Oxidoreductase 1), Nrf2 등 주요 항산화 유전자 발현은 감소한 반면, 소장의 회장에서는 Gpx1 및 Nrf2의 발현이 증가하는 조직 특이적 반응이 관찰되었다. Ding 등(2023)의 연구에 따르면, 35±2℃의 열 스트레스에 노출된 육계는 대조군(23±2℃)보다 간 내 SOD가 33.3%, GPX가 38.46% 감소하였다. Zhang 등(2022) 또한 39.5℃에서 6시간 동안 열 스트레스를 받은 닭에서 SOD, GPX, CAT 및 TAC 활성이 모두 유의하게 저하되었음을 확인하였다. 미토콘드리아는 세포 내 주요 에너지 생산 기관으로, ATP 생성을 포함한 다양한 생리적 기능을 조절한다. 특히 미토콘드리아 막전위(MMP)는 미토콘드리아의 기능적 상태를 나타내는 핵심 지표로, 산화적 인산화와 전자 전달계의 활성도를 반영한다(Kikusato and Toyomizu, 2013). MMP의 감소는 미토콘드리아 기능 저하의 신호이며, 세포 자가사멸 또는 괴사(necrosis)의 초기 단계에서 흔히 관찰된다(Iijima, 2006). 반대로, 스트레스 상황에서 일시적인 MMP 증가가 나타날 수 있으며, 이는 ATP 요구량 증가에 따른 미토콘드리아 활성화로 해석될 수 있다. 실제로 Liao 등(2022)은 열 스트레스를 받은 육계에서 ATP 수치, 상대적 MMP, 미토콘드리아 복합체 I 및 III의 활성이 모두 유의미하게 감소한다고 보고하였다. 그러나 Ouyang 등(2022)은 급성 열 스트레스 상황에서는 간 조직의 MMP가 오히려 증가하는 양상을 보였으며, 이를 에너지 대사 증가에 대한 일시적인 보상 반응으로 해석하였다. 이처럼 열 스트레스에 따른 MMP의 변화는 스트레스 강도, 노출 시간, 조직 유형 등에 따라 서로 다르게 나타날 수 있다.
가금류 생산에서 열 스트레스의 부정적인 영향을 완화하기 위해 다양한 전략이 사용되고 있으며, 이는 유전적 개량, 사양 환경 관리, 그리고 영양학적 개입을 포함한다. 그중에서도 식이 보충제는 적용이 간편하고, 빠르며, 비용 효율적인 방법으로 널리 연구되고 있다. 일반적으로 사용되는 보충제에는 플라보노이드, 카로티노이드, 폴리페놀 등을 포함한 파이토케미칼(phytochemicals), 시트룰린, 글루타민, 트립토판 등의 아미노산, 비타민 C, E를 포함한 비타민, 셀레늄, 아연 등을 포함한 미량 광물질 등이 있다.
레스베라트롤(resveratrol)은 땅콩, 포도, 기타 과일에 존재하는 비플라보노이드(nonflavonoid) 식물성 폴리페놀로 항염증 및 항산화 특성을 가진다(Malaguarnera, 2019; Zhang et al., 2017). Ding 등(2023)은 400 mg/kg 농도의 레스베라트롤을 육계에 급여한 결과, 열 스트레스(35±2℃, 7일) 하에서 Nrf2-Keap1 신호 경로를 통해 간의 항산화 능력이 증가하고, 성장 성과가 향상된다고 보고했다. 구체적으로, Nrf2 및 HO-1 유전자와 단백질 수치, NQO1, SOD 발현이 증가했고, HSP70, p62, Keap1 단백질은 감소하여 간 손상이 완화되었다. 또한, Lu 등(2023)은 레스베라트롤이 열 스트레스로 인한 육계의 폐 손상을 완화하는 효과와 그 작용 기전을 조사하였다. 열 스트레스는 육계의 성장 성적을 저하시킬 뿐만 아니라 폐의 산화적 손상과 염증을 유발하고, 항산화 및 자가포식 관련 유전자와 단백질 발현을 억제하였다. 반면, 레스베라트롤을 사료에 첨가하면 Nrf2 신호 경로와 자가포식을 활성화시켜 항산화 능력을 높이고 폐 손상을 완화하였다. 특히 LC3 II/LC3 I (세포 내 자가포식의 활성 정도를 평가하는 지표)비율과 Nrf2, HO-1, LC3B 등의 발현이 증가되었다. LC3(microtubule-associated protein 1 light chain 3)는 자가포식 과정에서 중심적인 역할을 하는 단백질로 자가포식이 활성화되면 LC3-I(세포질형)이 LC3-II(자가포식막에 결합된 형태)로 전환된다. 이 연구는 레스베라트롤이 열 스트레스를 받은 육계의 폐에서 자가포식 활성화를 유도하며 세포가 손상된 소기관이나 단백질을 제거하고 항상성을 유지하고 있음을 보여준다. Wang 등(2021)은 레스베라트롤이 육계의 근육과 비장 내 항산화 방어체계를 강화한다고 보고하였다. 따라서 레스베라트롤은 육계의 열 스트레스로부터 간, 폐를 보호하는 기능뿐만 아니라 근육과 비장 등에서 항산화적 작용으로 기능성 사료첨가제로 활용될 수 있음을 보여준다.
라이코펜(lycopene)은 토마토, 당근, 수박, 살구 등 다양한 과일과 채소에 자연적으로 존재하는 카로티노이드 색소이다. 최근 가금류 과학 분야에서는 라이코펜이 닭에서 열로 인한 산화 스트레스를 완화하는 능력으로 주목받고 있다. 그 작용 기전은 자유 라디칼을 제거하고, 산화 스트레스 관련 신호 전달 경로를 억제하며, SOD, GPX, CAT와 같은 내인성 항산화 효소의 발현을 촉진한다(Arain et al., 2018). 이러한 항산화 균형 조절 외에도, 라이코펜은 면역 기능 조절, 림프구 증식 억제, 지질 대사 개선 등의 효과를 나타낸다(Jang and Moon, 2015). 스트레스 환경에 있는 메추리에서 사료 내 토마토 분말 첨가 급여는 사료섭취량, 증체량, 사료효율 등을 개선하였다고 한다(Sahin et al., 2008). 이러한 생리적 효과는 열 스트레스를 받은 육계에서의 생존력과 생산성 향상으로 이어진다. 사료에 라이코펜을 200 또는 400 mg/kg 수준으로 첨가했을 때, 열 스트레스를 받은 브로일러에서 사료 섭취량, 체중 증가, 사료 효율이 유의미하게 개선된 것으로 보고되었다(Sahin et al, 2016). 전반적으로 라이코펜은 항산화 및 세포내 포도당, 지방대사, 면역 반응 등 대사 조절 기능을 통해 가금류 생산에서 열 스트레스를 완화할 수 있는 유망한 천연 첨가물로 간주된다.
Coenzyme Q10(CoQ10)은 미생물에서부터 고등동물에 이르기까지 자연계에 널리 분포하고 있다(Battino et al., 1990). CoQ10은 지용성 분자로서 세포의 막에 존재하고, 특히 미토콘드리아 막의 세포호흡 과정에서 전자의 수용과 산소로의 전달, 그리고 ATP 합성 등에 중요한 기능과 더불어 항산화제로서의 역할 등을 한다(Bhagavan and Chopra, 2006). 생체 내 열 스트레스 동안 닭의 심장에서의 CoQ10의 보호 기능과 Hsp70 발현과의 관계를 조사한 연구에서, 열 스트레스 이전에 식이로 공급된 CoQ10은 흡수되어 열 스트레스 동안에도 혈청 내 높은 수준으로 유지되었으며, CoQ10 처리군은 열 스트레스 그룹에 비해 SOD, MDA 등의 수치를 기준으로 열 스트레스 동안 심장의 산화 손상이 완화되었다고 한다(Xu et al., 2019). CoQ10에 대한 연구는 주로 항산화제, 대사성질환 억제 등의 연구에 관심이 집중되어 있으나 CoQ10의 사료 내 첨가 급여는 닭의 콜레스테롤과 지방의 합성도 억제할 수 있다(Jang and Moon, 2016; Kamisoyama et al., 2010).
커큐민(curcumin)은 강황(Curcuma longa)에서 유래한 대표적인 폴리페놀 화합물로, 강력한 항산화, 항염증, 그리고 면역조절 활성을 지닌 천연 생리활성물질로 미토콘드리아 기능 장애 예방에 점점 더 중요하게 여겨지고 있다(Gayathri et al., 2023). 특히 커큐민의 항산화 작용은 β-diketo group을 중심으로 양쪽에 위치한 두 개의 페놀기로부터 효과적인 수소 원자를 제공함으로써 이루어진다(Trujillo et al., 2014a). 이러한 구조적 특성은 활성산소종을 제거하는 데 중요한 역할을 한다. 가금류에서 열 스트레스는 ROS 생성의 증가, 산화 스트레스 유발, 미토콘드리아 기능 저하, 세포 에너지 대사 이상 등의 다양한 부정적인 생리적 반응을 초래한다. 이러한 스트레스 반응을 완화하기 위한 전략 중 하나로, 육계 사료에 커큐민을 보충하면 열 스트레스로 유도되는 산화 손상을 감소시키고 미토콘드리아 기능을 보호할 수 있음이 보고되었다(Zhang et al., 2018a; 2018b). 커큐민은 항산화 효소인 SOD, CAT, GPX의 활성을 증가시키며, ROS 생성을 억제함으로써 산화 스트레스를 경감시킨다. 이와 관련하여 핵심적인 조절자인 Nrf2 경로가 중요한 역할을 한다. Nrf2는 산화적 자극에 반응하여 억제 단백질인 Keap1로부터 분리되어 핵으로 이동하고, 하위 항산화 유전자들의 발현을 유도함으로써 세포 보호 기전을 활성화한다(Trujillo et al., 2014b). 실제로 열 스트레스에 노출된 육계의 간 조직에서 커큐민은 Nrf2 발현뿐 아니라 GPX, GST, HO-1, γ-GCLc의 활성을 촉진하고, 농도 의존적으로 CuZnSOD 및 CAT의 발현을 증가시켰다(Zhang et al., 2018b). 또한 커큐민은 미토콘드리아 수준에서도 보호 효과를 나타낸다. 간세포에서 미토콘드리아 막전위, ATP 생성량, 미토콘드리아 DNA 복제 수, MnSOD 발현이 모두 증가한 반면, ROS 생성은 유의하게 감소하였다. 이는 Trx2/Prx3 계열 항산화 단백질 및 MnSOD의 활성화를 통해 미토콘드리아 기능이 향상되었기 때문으로 해석된다(Zhang et al., 2018a). 더 나아가, 커큐민은 PGC-1α(peroxisome proliferator-activated receptor gamma coactivator 1-α)의 발현을 증가시켜 새로운 미토콘드리아 생성(mitochondrial biogenesis)을 유도한다. 이는 손상된 미토콘드리아를 대체하고, 세포의 에너지 대사 능력을 회복시키는 데 기여한다(Shelbayeh et al., 2023). 아울러, 커큐민은 염증 반응에 관여하는 전사 인자인 NF-κB와 염증성 사이토카인인 TNF-α의 활성을 억제함으로써 염증 반응을 완화하고 미토콘드리아 손상을 예방한다(Tuong et al., 2023). 이와 같이 커큐민은 열 스트레스 상황에서의 세포 손상을 줄이고, 육계의 성장과 면역력을 향상시키는 데 긍정적으로 작용할 수 있다. 커큐민은 항산화 시스템의 활성화, 염증 경로 억제, 미토콘드리아 기능 보호 및 생합성 촉진을 통해 열 스트레스로부터 가금류를 효과적으로 보호할 수 있는 유망한 영양학적 물질로 간주된다.
루틴(rutin)은 플라보노이드 계열의 플라보놀 배당체로 자연계에 널리 분포하며 다양한 식품과 약용 식물에서 발견된다. 밝은 노란색의 결정성 분말 형태를 띠며, 수용성은 낮은 편이다. 루틴은 항산화, 항염증, 면역조절 및 항암 효과 등 다양한 생리활성을 나타내는 것으로 보고되었다(Muvhulawa et al., 2022). 육계 연구에서 루틴은 장 기능 개선, 면역력 강화 및 항산화 능력 증진을 통해 성장 성능과 사료 효율성을 향상시키는 것으로 밝혀졌다(Chen et al., 2022). 특히 고온 스트레스(34℃)에 노출된 육계에 500 mg/kg의 루틴을 식이로 보충한 결과, 항산화 효소(SOD, GPX)의 활성과 TAC가 증가하고, MDA 농도는 유의하게 감소하였다(Chen et al., 2023a). 이는 루틴의 ROS 제거 능력과 항산화 방어체계 강화 기능을 보여주는 결과이다. 또한 루틴은 열 스트레스에 따른 미토콘드리아 손상을 완화하는 데에도 기여한다. 루틴 보충은 미토콘드리아의 형태적 보존, mtDNA 복제 수 증가 및 미토콘드리아 기능 유전자 발현 조절을 통해 미토콘드리아 항상성을 유지하는 것으로 나타났다. 특히 PGC-1α, NRF1(nuclear respiratory factor 1), TFAM (mitochondrial transcription factor A)의 발현이 루틴 투여군에서 유의하게 증가하였으며, 이는 미토콘드리아 생합성 촉진과 관련이 있다(Chen et al., 2023b). 한편 이러한 효과는 AMPK (AMP-activated protein kinase) 경로의 억제를 통해 매개될 수 있다. AMPK는 일반적으로 에너지 항상성을 조절하는 신호 전달체계로, 루틴에 의해 그 활성이 억제되면서 미토콘드리아 생성을 유도하는 것으로 추정된다. 또한 루틴은 PINK1-Parkin 경로를 억제함으로써 과도한 미토파지를 억제하고, 미토콘드리아 기능과 구조의 안정성을 유지하는 데 기여할 수 있다(Chen et al., 2023b). 결론적으로, 루틴은 열 스트레스에 따른 산화 스트레스와 미토콘드리아 손상을 완화하고, 미토콘드리아 생성을 촉진함으로써 육계의 대사 건강과 생산성을 개선할 수 있는 유망한 식이성 생리조절 물질로 평가된다.
메티오닌(methionine)은 가금류의 최적 성장과 깃털 합성, 생화학적 반응(메틸기 공여자 역할), 근육 축적에 중요한 역할을 한다(Fagundes et al., 2020). 또한 메티오닌은 단백질 합성, DNA 메틸화 반응, ROS 제거에 관여하며, GSH의 전구체 역할을 한다. 글루타치온(GSH)은 ROS를 제거함으로써 세포를 산화 스트레스로부터 보호하는 삼(tri)펩타이드 항산화물질이다(Kidd, 2004). 따라서 메티오닌은 산화적 변형에 민감한 아미노산이며, 식이에 메티오닌을 포함시킬 경우 42일령 육계의 성장 성과가 향상되는 것으로 나타났다(Wen et al., 2017). 이전 연구의 대부분은 단일 아미노산 형태인 메티오닌 보충이 육계의 열 스트레스 완화에 도움이 될 수 있는지에 대한 연구였다. 최근에는 성장기 동안 열 스트레스를 받은 육계를 대상으로 dipeptide 형태인 DL-메티오닐-DL-메티오닌 형태의 메티오닌 보충 효과에 대한 보고가 있다. Santana 등(2021)의 연구 결과에 따르면, 자유형 메티오닌 또는 메티오닌 디펩타이드를 육계 사료에 보충하면 글루타티온 항산화 시스템과 관련된 유전자 활성화를 증가시켜 열 스트레스의 영향을 완화하는 데 도움이 될 수 있으나 공급하는 메티오닌의 형태에는 차이가 없다고 한다. 메티오닌 보충은 DL-메티오닌 또는 그 유사체인 DL-2-hydroxy-4-methyl thiobutanoic acid(DL-HMTBA) 형태로 제공될 수 있다. DL-메티오닌과 DL-HMTBA의 보충의 비교에서 열 스트레스를 받은 육계의 항산화 능력에 미치는 효과는 차이가 없으며, DL-메티오닌과 DL-HMTBA는 시스테인과 글루타티온의 전구물질로서 DL-HMTBA 보충 또한 항산화 성분의 활성에 미치는 작용이 글루타티온 시스템과 관련되어 있음을 보여주었다(Gasparino et al., 2018). 글루타민(glutamine)은 면역세포 및 장 점막 세포의 증식을 위한 질소와 에너지원으로 작용하며, 시스테인과 함께 항산화물질인 GSH를 합성하는 데 필요하다(Obled, 2003). 또한 글루타민은 감염, 외상, 고온 등 스트레스 상황에 처한 동물에게 필수적인 영양소로 간주된다(Soltan, 2008).
트립토판(tryptophan)은 육계의 성장, 번식, 면역 기능 유지에 필수적인 기능성 아미노산으로, 스트레스 완화 및 산화 스트레스 조절에도 관여하는 것으로 알려져 있다(Mund et al., 2020). 식이 중 트립토판의 보충은 육계의 성장률 및 사료 이용 효율을 개선하며, 장 점막의 산화 손상을 완화하고 면역 반응을 향상시키는 효과를 나타낸다(Yue et al., 2017). 특히 트립토판은 다양한 스트레스 조건, 예를 들어 급성 및 만성 열 스트레스 환경에서 그 효과가 두드러진다. 열 스트레스는 장과 간 조직에서 ROS 생성을 증가시키고, 미토콘드리아 구조와 기능에 손상을 초래하는 주요 원인으로 작용한다. 트립토판 보충은 이러한 산화 스트레스를 완화하며, 미토콘드리아의 항산화 능력을 향상시키는 것으로 보고되었다(Liu et al., 2019). 육계에서 열 스트레스는 소장 점막 내 TFAM, COX1, COX5A의 mRNA 발현을 억제하는 반면, 트립토판의 보충은 미토콘드리아 막 전위를 유지하고, TFAM과 COX1의 유전자 발현을 증가시켜 미토콘드리아 구조의 손상을 줄이는 데 기여한다(Ouyang et al., 2023). Ouyang 등(2022)은 육계 사료에 0.18% 트립토판을 첨가하면 고온 노출에 따른 미토콘드리아 기능 저하 및 산화 스트레스 반응을 효과적으로 억제한다고 보고하였다. 이 효과는 SOD, CAT, GPX 등 항산화 효소 활성을 증가시키고, PGC-1α, Cyt-c, COX1, COX5A, SIRT1 등 미토콘드리아 기능 관련 유전자의 발현을 유도함으로써 달성된다. 열 스트레스에 노출된 육계의 간 조직에서 Nrf2 단백질 수준이 유의하게 증가하는 것은 열 자극에 대한 방어 반응으로 Nrf2 신호 경로가 활성화됨을 시사하며, 이는 항산화 효소 유전자 발현 증가 및 글루타티온(GSH) 수준 상승과 관련된다(Miao et al., 2020). 따라서, 트립토판 보충은 열 스트레스로 인한 산화 스트레스를 완화하고 미토콘드리아 기능을 개선함으로써 육계의 생리적 항상성 유지에 기여할 수 있으며, 이는 효과적인 영양학적 스트레스 대응 전략으로 고려될 수 있다.
L-시트룰린(L-citrulline)은 비필수 아미노산으로 요소 회로 중간체이며 수박, 멜론류, 오이, 호박류 등에 존재한다(Kaore et al., 2013). 체내에서 L-아르기닌의 전구체로 작용하며, NO(nitric oxide) 생성과 혈관 확장에 기여한다(Moinard and Cynober, 2007). L-시트룰린은 대사 안정성이 높아 아르기닌보다 더 효과적으로 NO 농도를 증가시킬 수 있으며, 현재까지 동물에 대한 부작용은 보고되지 않았다(Breuillard et al., 2015). L-시트룰린은 병아리와 육계에서 체온 저하 및 열 저항성 증가를 유도하는 보충제로 평가받고 있다(Chowdhury et al., 2021). 이 연구에서 L-시트룰린이 열 스트레스 바이오마커 아미노산 역할을 한다고 하였으며, 열 스트레스 조건에서 L-시트룰린 농도가 체내에서 현저히 감소하는 것을 보고하였다. 이는 NO를 통한 혈류 증가와 체온 조절 효과 때문으로 보인다. 온도 중립 환경(24℃)과 열 스트레스 환경(35℃, RH 60%, 5시간)에서 브로일러에 1% L-시트룰린을 보충한 실험 결과, 체온이 유의하게 감소하고 항산화 방어 기전이 활성화되었으며, 시상하부의 열 충격 반응이 유지되었다(Uyanga et al., 2021). 또한, 수박 껍질을 이용한 농업 부산물 보충 실험에서도 유사한 효과가 입증되었다(Nguyen et al., 2020). L-시트룰린은 ROS 제거 및 DNA 보호 등 항산화 및 항염증 특성을 보이며(Moinard et al., 2007), NO 생성을 통해 혈류를 조절함으로써 산화 스트레스를 완화한다. Uyanga 등(2022)은 L-시트룰린 보충을 통해 열 스트레스 하에서 육계의 COX3, TFAM, ATP5β mRNA 발현 증가를 유도하고, 체온 감소, 지질 과산화 억제, 면역 기능 향상이 가능함을 밝혔다. 또한 이들 연구자들에 의하면 L-시트룰린은 미토콘드리아 막 전위, mtDNA, ATP 양, 항산화 유전자 발현 등 미토콘드리아 기능 회복에도 긍정적 영향을 확인하였다.
비타민 E는 토코페롤(tocopherol)과 토코트리에놀(tocotrienol)을 포함하는 화합물이다. 그 중 알파-토코페롤(α-tocopherol)은 생물학적으로 가장 활성이 높은 형태로, glutathione peroxidase 경로에 관여하여 지질과산화 반응에서 생성된 지질 라디칼과 반응함으로써 생체를 산화적 손상으로부터 보호한다(Traber and Stevens, 2011). 산화된 α-토코페롤 라디칼은 비타민 C(ascorbate, 아스코르빈산)과 같은 다른 항산화제에 의해 환원되어 다시 활성화된 형태로 재생된다. 비타민 C는 항산화제 또는 산화촉진제로 작용할 수 있으며, 비타민 E의 분해 대사를 억제함으로써 비타민 E의 수준을 유지시키고 항산화 효과를 증가시키는 데 도움을 준다(Shakeri et al., 2020). 비타민 E는 위와 같은 생리적 항산화제 기능에 의해 골격근 및 혈장 내 자유 라디칼을 중화하여 육계의 성장 및 생리적, 면역학적 상태를 개선하는 데 기여한다(Gao et al., 2010; Selim et al., 2013). 비타민 E를 평균 250 mg/kg의 농도로 첨가하는 것은 열 스트레스 증상을 완화하기 위한 효과적인 보호 방법이며, 이는 육계의 최적 성장과 향상된 육질로 이어질 수 있다(Habibian et al., 2014). 열 스트레스는 혈청과 간에서 MDA의 농도를 증가시키는 반면, 비타민 E는 지질 과산화 및 세포 손상을 억제함으로써 간에서 MDA의 생성을 감소시키고, 그 결과 닭의 생산성을 향상시키는 효과를 나타낸다(Sahin et al., 2001). 페놀류, 플라보노이드, 알칼로이드는 항산화 활성을 가진 주요 식물 생리활성 화합물로, 비타민 E와 상승적으로 작용하여 그 항산화 능력을 증강시키는 것으로 보고되었다(Sonam and Guleria, 2017). 따라서 비타민 E는 단독뿐만 아니라 셀레늄, 식물성 항산화물들과 함께 가금류 영양에서 주요한 사료 보충 항산화제로 간주된다(Surai and Kochish, 2019).
비타민 C는 수용성 항산화 화합물로, 세포를 산화적 손상으로부터 보호하고 면역 체계 기능을 향상시키는 역할을 한다(Abidin and Khatoon, 2013). 이 비타민은 스트레스 상황에서 에너지 공급을 증가시키는 호르몬인 코르티코스테론의 생합성에도 중요한 역할을 한다(Ahmadu et al., 2016). 가금류는 체내에서 비타민 C를 생성할 수 있다(Maurice et al., 2002). 비타민 C는 조류에서는 신장에서, 일부 포유류에서는 간에서 합성된다(Ahmadu et al., 2016). 하지만 이러한 내인성 생산만으로는 특히 환경적 스트레스가 심한 상황에서는 가금류의 생리적 요구를 충족시키기에 충분하지 않은 것으로 간주된다(Pardue and Thaxton, 1986). Sahin 등(2001)은 비타민 C가 열 스트레스 하에서 사육된 가금류의 생육 성과와 도체 특성을 개선할 수 있다고 보고했다. 사료에 비타민 C를 200 mg/kg 수준으로 보충하면 고밀도 사육의 부정적인 영향을 줄이고, 최종 체중을 증가시키며, 폐사율을 낮추고, 간에서의 열충격단백질 70(HSP70) 발현 수준을 감소시켰다(Shewita et al., 2019). 또한 비타민 C는 세포 수준에서의 항산화 방어에 중요한 역할을 한다(Ahmadu et al., 2016). Seven(2008)은 비타민 C가 모든 종류의 산소종과 반응하여 비활성 라디칼 형태인 디하이드로아스코르빌을 형성하고, 지질층에서 생성한 라디칼을 제거함으로써 항산화제로 작용한다. 비타민 C는 다른 항산화제와 함께 상승 작용을 통해 보조 항산화제로 작용할 수 있다. Doba 등(1985)의 연구에 따르면, 비타민 C는 토코페록시 라디칼(tocopheroxy radicals)을 다시 활성형 비타민 E로 환원시킴으로써 비타민 E의 항산화 활성을 증가시키는 것으로 나타났다. 최근 문헌에 따르면, 성체 가금류는 정상적인 조건에서 자체적으로 비타민 C를 합성하여 요구량을 충족시킬 수 있다. 그러나 스트레스 상황에서는 비타민 C의 요구량이 증가하며, 여러 연구에서 비타민 C를 사료에 보충했을 때 가금류에 유익한 효과가 있음을 보고하였다(Abidin and Khatoon, 2013; Maurice et al., 2002).
Mn(망간), Zn(아연), Cu(구리)는 항산화 효소인 SOD의 구조적 성분이자 촉매 역할을 하며, 흉선 펩타이드, 사이토카인, 각종 효소 등 면역 조절 인자에도 작용한다(Shakeri et al., 2020). 특히 아연(Zn)은 육계의 면역 기능 유지(Kidd et al., 1996), 성장(Liu et al., 2011), 골격 발달에 중요한 기여를 한다. Abd El-Hack 등(2017)은 아연이 강력한 항산화 작용 외에도 췌장 호르몬(글루카곤 및 인슐린), 성장 호르몬, 성호르몬 등 다양한 호르몬 기능에 관여한다고 보고했다. Sahin 등(2005)에 따르면, 아연은 췌장 조직에서 산화 손상을 방지하고 소화 효소의 분비를 촉진하여 영양소 소화를 촉진하는 데 기여한다. Zago와 Oteiza(2001)는 아연이 항산화 방어 네트워크의 핵심 요소로서 세포막 손상을 억제하고, 자유 라디칼 및 기타 반응성 물질의 생성을 부분적으로 억제할 수 있다고 밝혔다. 또한 아연은 세포질 내 Cu/ZnSOD의 필수 구성 성분으로서 대사 경로에 직접 참여하고, 산화 스트레스로부터의 세포 방어에 핵심 역할을 한다(Zago and Oteiza, 2001). 열 스트레스 조건에서 아연은 비타민 E와 상승 작용을 나타내며, 이들의 병용은 육계의 생산성에 긍정적인 영향을 미친다(Salgueiro et al., 2000). 비타민 E와 아연의 조합은 열 스트레스로부터 육계를 보호하는 중요한 항산화 방어막으로 간주된다. 셀레늄(Se)은 매우 강력한 천연 항산화 물질 중 하나로 건강 증진에 중요한 역할을 한다. 셀레늄은 두가지 형태 즉, 무기 형태(selenate, selenite)와 유기 형태(selenomethionine, selenocysteine)로 존재한다. 셀레늄은 GPX, SOD 등의 항산화 효소에서 보조 인자로 기능한다. 식이 셀레늄 보충은 CAT, SOD, GPX의 활성을 증가시키고, 산화 스트레스 및 지질 과산화 지표를 감소시켰다(Cai et al., 2012). 셀레늄은 조직의 구조적 완전성을 유지하고, 산화 스트레스로부터 신체를 보호하며, 산화 스트레스를 유발 요인으로 하는 질병의 발생을 예방한다(Pappas et al., 2008). Jing 등(2023)의 연구진은 열 스트레스를 받은 육계 사료에 셀레늄 메티오닌(SeMet)을 보충하면 간의 셀레늄 농도가 증가하고, 여러 핵심 셀레늄 단백질의 발현을 촉진함으로써 항산화 능력을 향상시키고, 미토콘드리아 기능 장애 감소, 이상적인 TCA 회로 작동, 소포체 스트레스 완화 등을 확인하였다고 한다. Horvath와 Babinsky(2018)는 셀레늄이 직접적으로는 ROS 생성을 억제하지 않지만, 효소의 보조 인자로 작용함으로써 간접적으로 ROS의 생성을 억제하는 역할을 한다고 제시하였다.
Ⅲ. 결 론
지구 온난화와 기후 변화로 인한 가축의 열 스트레스는 더 빨리, 더 자주, 더 심하게 온다. 열 스트레스는 내분비계, 대사계 및 면역계에 많은 부정적인 영향을 미치며, 이는 닭의 포함한 전 세계 동물 생산에 막대한 경제적 손실을 초래한다. 열 스트레스는 활성산소 생성, 미토콘드리아 막 전위 소실 및 미토콘드리아 산화-환원 상태의 불균형과 관련이 있으며, 이에 따라 육계의 미토콘드리아 기능이 손상되는 것으로 밝혀졌다. 미토콘드리아가 영양소 대사와 세포 항상성 조절에 중요한 역할을 한다는 점, 그리고 열 스트레스 환경에서 관찰되는 닭의 사료 효율 및 영양소 이용률 감소 등을 고려할 때 미토콘드리아 기능 이상을 해소하거나 예방하는 것이 무척 중요하다고 할 수 있다. 미토콘드리아의 기능 유지와 열 스트레스 해소를 위한 다양한 방법들이 있을 수 있지만 단기적으로는 위에서 소개한 항산화물질뿐만 아니라, 비타민 E와 C, 셀레늄, 나트륨과 칼륨, 아연 망간 등을 포함한 미네랄, 트립토판, 메티오닌, 아르기닌 등의 아미노산, 프로바이오틱스 등을 공급하는 것이 중요하다고 할 수 있다(Fig. 2). 예상되는 고온 환경에 앞서 조기에 식이 보충제를 공급하는 것은 육계의 열 스트레스 저항성을 높이기 위한 실용적인 전략이 될 수 있다. 추후 연구에서는 다양한 열 스트레스 강도에 따른 항산화제의 병용 효과, 조직 특이적 반응, 그리고 적정 투여 용량의 최적화에 중점을 두어야 할 것으로 사료된다.