ARTICLE
식물 5종 추출물의 항산화 활성 비교
이정아
1,3
, 김학연
1,2
, 최정석
4
, 이충렬
3
, 이솔희
4,*
Comparison of Antioxidant Activities in 5 Plant Extracts
Jeong-Ah Lee
1,3
, Hack-Youn Kim
1,2
, Jung Seok Choi
4
, Chung Yeol Lee
3
, Sol-Hee Lee
4,*
1Department of Animal Resources Science, Kongju National University, Yesan 32439, Korea
2Resources Science Research, Kongju National University, Yesan 32439, Korea
3Department of Smart Farm and Food Convergence, Hyejeon College, Hongseong 32244, Korea
4Department of Animal Science, Chungbuk National University, Cheongju 28644, Korea
*Corresponding author : Sol-Hee Lee Department of Animal Science, Chungbuk National University, Cheongju 28644, Korea, Tel : +82-43-261-2551 E-mail :
leesh73@chungbuk.ac.kr
© Copyright 2025 Resource Science Research Institute, Kongju National University. This is an Open-Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0/) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Mar 04, 2025; Revised: Apr 17, 2025; Accepted: May 08, 2025
Published Online: Jun 30, 2025
Abstract
This study was conducted to evaluate the antioxidant activity of 5 plant extracts (garlic, acai berry, acenthopanax, Asian lizard’s tail, sericea lespedeza). Extracts from these plants were vacuum-concentrated, freeze-dried, and subsequently analyzed. Antioxidant activity was assessed through ABTS⁺ radical scavenging activity, DPPH radical scavenging activity, ferric reducing antioxidant power (FRAP), total polyphenol content (TPC), and total flavonoid content (TFC). Among the 5 plant extracts, Asian lizard’s tail exhibited the highest ABTS+(80.58%) and DPPH (75.29%) radical scavenging activity (p<0.05). The FRAP assay revealed that Asian lizard’s tail demonstrated the highest reducing power (88.33 mg TE/mL), followed by acai berry (67.61 mg TE/mL), sericea lespedeza (39.88 mg TE/mL), acanthopanax (28.30 mg TE/mL), and garlic (23.15 mgTE/mL) (p<0.05). Furthermore, Asian lizard’s tail exhibited the highest TPC (11.76 mg GAE/mL) and TFC (17.98 mg NE/mL) among the tested plant extracts (p<0.05). Based on these findings, Asian lizard’s tail has potential as a natural antioxidant that could replace synthetic antioxidants. Additionally, it may serve as a candidate for the development of natural antioxidants in cell culture applications.
Keywords: Plant extract; Antioxidant activity; Radical scavenging activity; Polyphenol; Flavonoid
Ⅰ. 서 론
최근 현대인들의 건강에 대한 관심이 증가되고 있으며, 균형 잡힌 식단과 채소 섭취에 대한 중요성이 강조되고 있다(Melbye et al., 2021). 열량이 높고 영양소가 적은 식품이 확산되면서 지방섭취가 늘고 섬유소섭취가 줄어 만성질환이 증가하고 있으며, 이를 예방하기 위한 항산화 물질에 대한 관심이 지속적으로 높아지고 있다(Kim et al., 2024; Son et al., 2024). 섬유소가 풍부한 채소들은 수분이 풍부하고 열량이 낮으며, 항산화물질인 폴리페놀, 플라보노이드 및 비타민 등의 함량이 높다고 알려져 있다(Knez et al., 2022).
항산화작용은 산화적 손상을 일으키는 자유라디칼로부터 채내 세포를 보호하는 과정을 말하며, 항산화물질은 자유라디칼 제거, 산화효소 억제 및 과산화물 분해 등의 역할을 하여 산화적 손상으로부터 보호하는 역할을 한다(Jomova et al., 2024; Ozawa et al., 2022). 체내는 정상적인 생명유지를 위해 지질, 단백질, DNA, 세포 분화 및 호흡 등 대사과정에서 산화반응이 일어나고 있다(Rajendran et al., 2014). 이러한 기전에 관여하는 것이 hydrogen peroxide, hydroxyl radical, hydroperoxyl radical, superoxide anion radical, peroxyl radical 등과 같은 활성산소종으로 자유기상태로 존재하며 지속적으로 생성된다(Pizzino et al., 2017; Sato et al., 2013). 이는 생체내에서 반드시 필요한 물질로 외부 항원 방어 및 세포성장촉진의 역할을 하지만 물리적, 화학적 요인에 의하여 균형이 무너지면 산화적 손상을 일으켜 암, 당뇨병, 심혈관계 질환 등 만성질환의 원인으로 알려져 있다(Hybertson et al., 2011; Pastore and Korkina, 2010; Yang et al., 2023).
항산화제는 합성 항산화제와 천연물 유래 항산화제로 나뉘며, 합성 항산화제인 butylated hydroxytoluene(BHT)는 자유라디칼의 반응을 억제시키고 butylated hydroxyanisole(BHA)는 항산화제를 합성하는 기능을 가지고 있어 식품산업에서 항산화제로 많이 쓰이고 있다(Yehye et al., 2015). 그러나 BHT, BHA 등의 합성 항산화제는 체내에 일정량 이상 흡수될 경우 체내 효소나 지방의 변이, 발암, 독성 및 안전성의 문제로 인하여 소비자의 거부감이 심해짐에 따라, 안전하고 응용가능성이 높은 폴리페놀 및 플라보노이드 화합물을 포함한 천연 항산화제에 대한 연구가 이루어지고 있다(Ito et al., 1985; Parke & Lewis, 1992; Wang et al., 2022). 하지만 세포배양시 인공배양액을 천연물질로 대체하기 위하여 사용가능한 천연항산화 소재 탐색에 대한 연구는 아직 보고된 바 없다.
따라서 본 연구는 항산화 능력이 뛰어난 식물 5종(마늘, 아사이베리, 오가피, 삼백초, 비수리)의 항산화 활성을 비교하고 세포배양액에서 천연 항산화제로 가능성이 있는 소재를 확보하기 위한 기초자료로 활용하고자 한다.
Ⅱ. 재료 및 방법
1. 조사대상 선정 및 추출물 준비
본 실험에 사용된 식물 5종(마늘, 아사이베리, 오가피, 삼백초, 비수리)의 선정은 과채류 8종의 항산화 비교 연구(Jeong et al., 2015), 약용식물 20종의 항산화 탐색(Kim et al., 2004), 자생식물 26종과 생약자원 14종의 항산화 탐색(Kim et al., 2012), 채소류 24종의 항산화 비교 연구(Suh et al., 2013)를 근거로 항산화 능력이 뛰어난 5가지의 대표 식물을 선정하였다. 마늘, 아사이베리, 오가피, 삼백초, 비수리는 동결건조 분말형태로 각각 금보종합식품, 엄마농장, 두손애약초, 가루랑에서 구입하였다. 시료 4 g과 증류수 40 mL를 넣고 약 3시간 동안 25 rpm으로 실온에서 교반 후 혼합물을 centrifuge (Supra R22, Hanil, Korea)에서 4℃, 8,000 rpm 조건으로 20분간 원심분리하였다. 상등액을 추출액은 filter paper(Whatman No. 1, GE Healthcare, USA)에 여과하여 45℃ 진공회전농축기(IKA. Ltd, Staufen, Deutschland)를 이용하여 감압농축시킨 후 동결건조하여 추출물을 제조하였다.
2. ABTS+ 라디칼 소거능
2,2-Azinobis-3-ethylbenzo thiazoline-6-sulfonic acid(ABTS) radical 소거능은 Re 등(1999)의 방법을 변형하여 측정하였다. 14 mM ABTS와 4.9 mM potassiun persulfate를 1:1로 섞어 24시간 동안 암실에서 방치하여 radical 생성을 유도하였다. 그 후 multi-mode 플레이트 리더기(SpectraMax iD3, Molecular Devices, USA)를 사용하여 734 nm에서 흡광도 값이 0.70±0.02 정도가 되도록 에탄올로 희석하여 사용하였다. ABTS+ 라디칼 용액 3 mL와 각 농도별로 제조된 시료를 각 20 μL 혼합하여 실온 어두운 곳에서 30분간 반응시킨 multi-mode microplate reader(SpectraMax iD3, Molecular Devices, USA)를 사용하여 734 nm에서 흡광도를 측정하였다.
3. DPPH 라디칼 소거능
Choe 등(2014)의 방법을 변형하여 2,2-diphenyl-1-picrylhydrazyl(DPPH) 라디칼 소거능을 측정하였다. 추출물 1 mL와 DPPH 용액 1 mL를 혼합하고 어두운 곳 실온에서 30분 동안 반응시켰다. 반응물을 multi-mode 플레이트 리더기(SpectraMax iD3, Molecular Devices, USA)로 517 nm에서 흡광도를 측정하였다.
4. 환원력(Ferric Reducing Antioxidant Power Assay) 측정
Dudonné 등(2009)과 Luqman 등(2012)의 방법을 이용하여 식물 추출물의 환원력을 측정하였다. 0.3 M sodium acetate buffer와 20 mM FeCl3, 40 mM HCl에 녹인 10 mM TPTZ를 10:1:1의 비율로 섞고 37℃에서 15분 이상 반응시켜 준비하였다. 추출물 1 mL와 FRAP 시약 3 mL를 혼합하고 암실에서 37℃, 15분간 반응시켰다. Multi-mode 플레이트 리더기(SpectraMax iD3, Molecular Devices, USA)를 이용하여 593 nm에서 흡광도를 측정하였다.
5. 총 페놀 함량 측정
Folin–Ciocalteu 방법(Singleton and Rossi, 1965)을 이용하여 총 페놀 함량을 측정하였다. 각각의 추출물에 2 N Folin-Ciocalteu 용액 80 μL를 혼합하고 3분 동안 반응시켰다. 혼합물에 20% Na2CO3를 800 μL 넣고 암실에서 37℃, 30분간 반응시켰다. Multi-mode 플레이트 리더기(SpectraMax iD3, Molecular Devices, USA)을 이용하여 760 nm에서 흡광도를 측정하였다.
6. 총 플라보노이드 함량 측정
Woisky와 Salatino(1998)의 방법을 변형하여 총 플라보노이드 함량을 측정하였다. 각각의 추출물 100 μL와 diethylene glycol 1 mL, 1 N NaOH 100 μL를 혼합하고 암실에서 37℃, 1시간 반응시켰다. Multi-mode 플레이트 리더기(SpectraMax iD3, Molecular Devices, USA)를 이용하여 420 nm 에서 흡광도를 측정하였다.
7. 통계분석
본 연구의 모든 실험 결과는 최소 3회 이상의 반복 실험하여 평가하였다. 이후 통계프로그램 SAS (version 9.3 for window, SAS Institue, USA)를 사용하여 평균값과 표준편차로 결과를 나타내었으며, 분산분석(ANOVA)에서 던컨시험(Duncan’s multiple range test)을 이용하여 각 평균의 유의차가 있는지 95% 수준에서 검증하였다.
Ⅲ. 결과 및 고찰
1. ABTS+ 라디칼 소거능
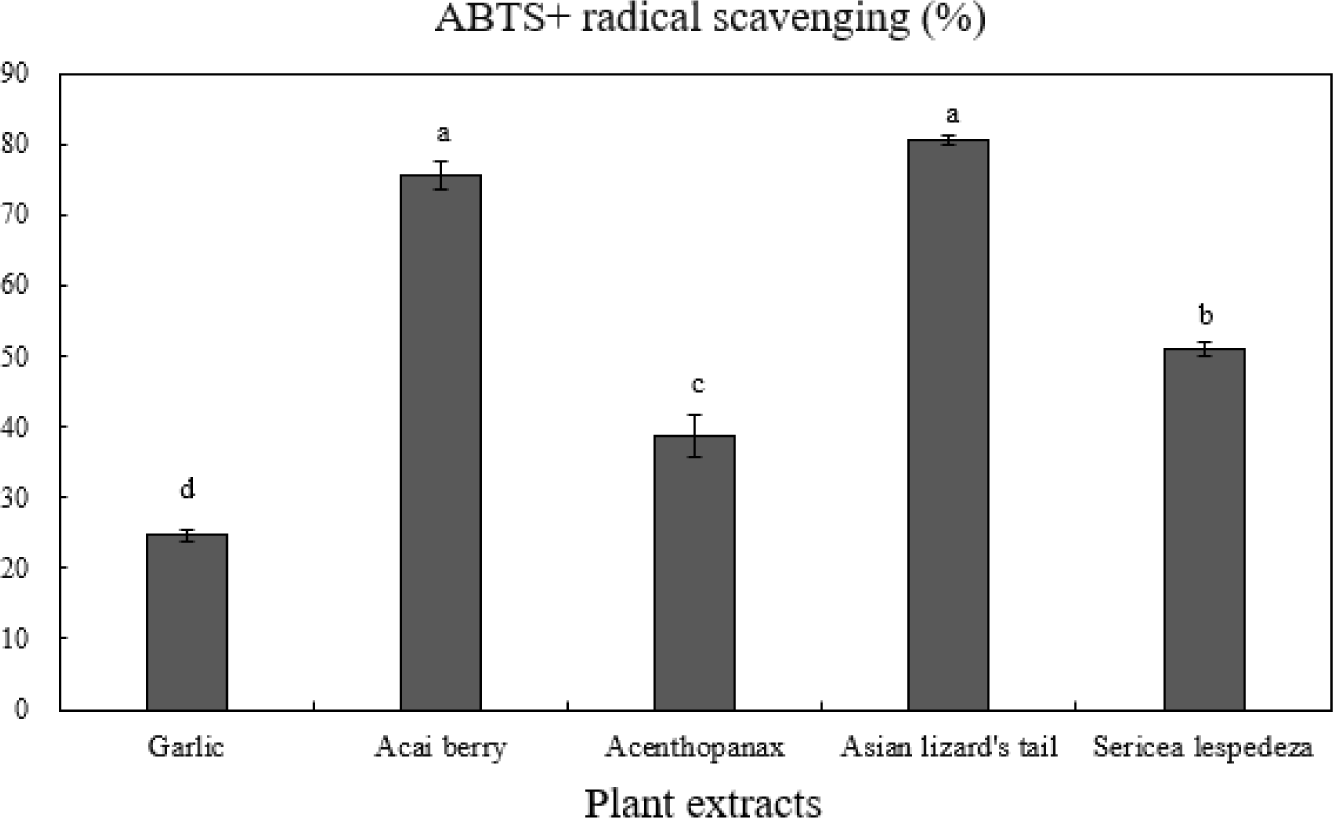
ABTS radical 소거능 측정방법은 ABTS 용액과 과황산칼륨의 반응으로 생성된 ABTS 양이온이 항산화물질과 반응하면 ABTS 양이온의 색인 청록색이 탈색되는 원리를 이용한 측정방법이다(Gulcin 2020). 또한 소수성 물질과 친수성 물질의 측정이 가능하여 DPPH보다 폭 넓은 물질에 대한 활성을 나타낸다고 알려져 있다(Re et al., 1999). Fig. 1은 식물 5종 추출물의 ABTS+ 라디칼 소거능 결과를 나타내었다. 식물 추출물 중 삼백초(80.58%)와 아사이베리(75.54%)가 유의적으로 가장 높은 ABTS+ 라디칼 소거능력을 보였으며, 비수리(50.92%), 오가피(38.69%), 마늘(24.62%) 순으로 측정되었다(p<0.05). 분쇄방법에 따른 삼백초의 항산화 활성 측정 연구에서도 삼백초의 ABTS+ 라디칼 소거능을 측정한 결과 분쇄방법에 상관없이 97%의 높은 소거능을 나타내어 본 연구와 일치하는 경향을 보였다(Jo, 2014). 또한 ABTS+가 DPPH보다 연쇄절단형 항산화제와 수소공여 항산화제 모두 측정할 수 있고, 수용성 및 유기성 물질 모두 적용가능하기 때문에 ABTS+ radical 소거능이 더 높게 측정되었다는 연구와 일치하였다(Jeong et al., 2011; Kang et al., 2017).
Fig. 1.
ABTS+ radical scavenging activity of 5 plant extracts.
a-dMeans on bars with different letters are significantly different (p<0.05).
Download Original Figure
2. DPPH 라디칼 소거능
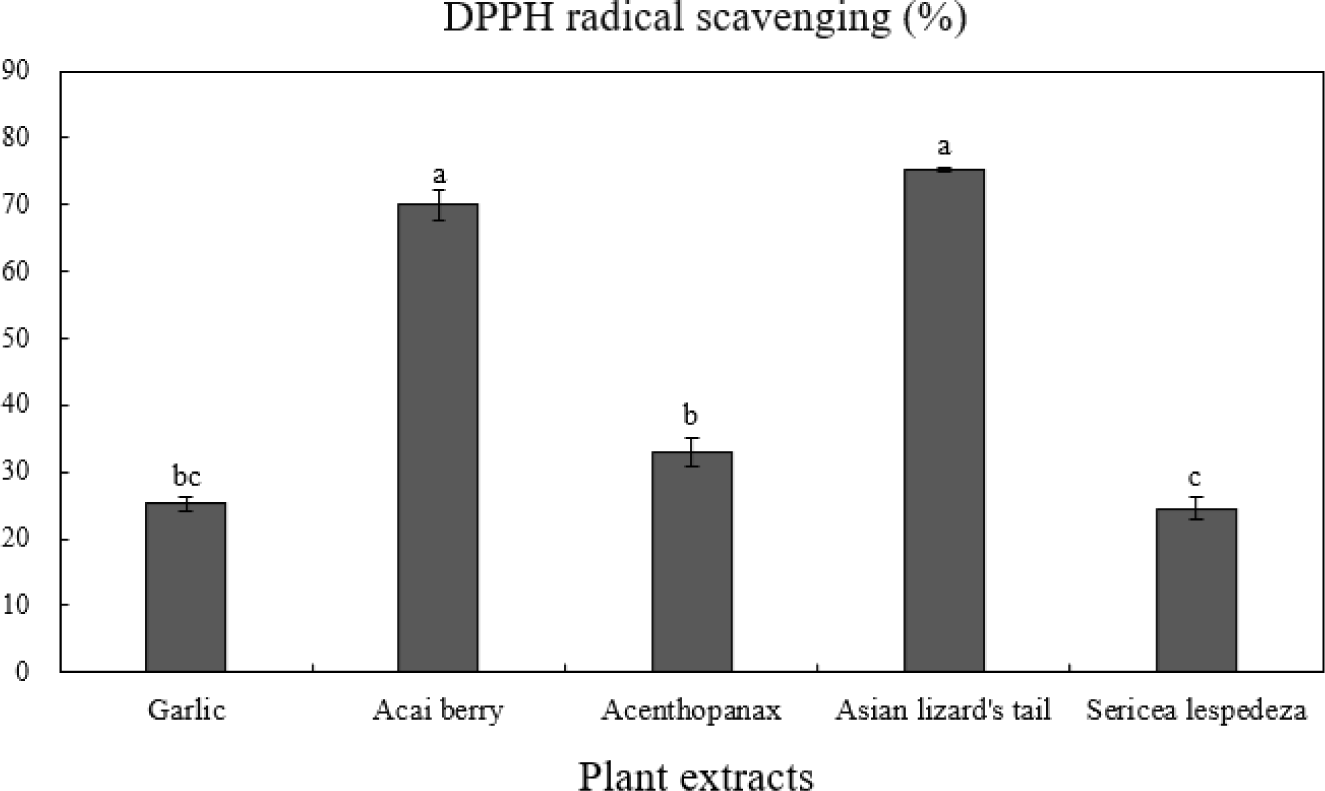
DPPH radical은 안정된 자유라디칼로 에탄올에서 보라색 용액을 생성하며, 항산화 활성을 갖는 물질인 방향족 아민류 등과 반응하면 수소 전자를 받고 환원되어 DPPH radical은 감소하고 탈색되어 노란색으로 탈색되는 항산화능 측정법이다(Bondet et al., 1997). DPPH는 수용성 및 유기성 물질의 항산화능 측정법으로 널리 이용되고 있다(Choi and Shin, 2015). Fig. 2는 식물 5종 추출물의 DPPH 라디칼 소거능 결과를 나타내었다. 식물 추출물 중 삼백초(75.29%)와 아사이베리(69.96%)가 유의적으로 가장 높은 DPPH 라디칼 소거능력을 보였으며, 오가피(32.95%), 마늘(25.22%), 비수리(24.59%)순으로 측정되어 ABTS+ 라디칼 소거능 측정결과와 유사한 경향을 나타내었다(p<0.05). ABTS+는cation radical 소거 활성, DPPH는 free radical 소거활성을 측정하는 방법으로 두 기질과 반응물과의 결합 정도가 달라 radical 소거 활성능력에 차이가 있으나 유사한 경향을 나타낸다고 보고하였다(Shin et al., 2010). 또한 김 등(2012)의 생약자원 추출물의 항산화 탐색 연구에서 삼백초가 66.27%로 생약식물 중에서 유의적으로 높은 DPPH 라디칼 소거능을 나타내어 본 연구와 유사하였다. 따라서 ABTS+와 DPPH 측정결과 삼백초가 가장 뛰어난 radical 소거 활성능력을 가지고 있다고 판단된다.
Fig. 2.
DPPH radical scavenging activity of 5 plant extracts.
a-cMeans on bars with different letters are significantly different (p<0.05).
Download Original Figure
3. 환원력(FRAP)
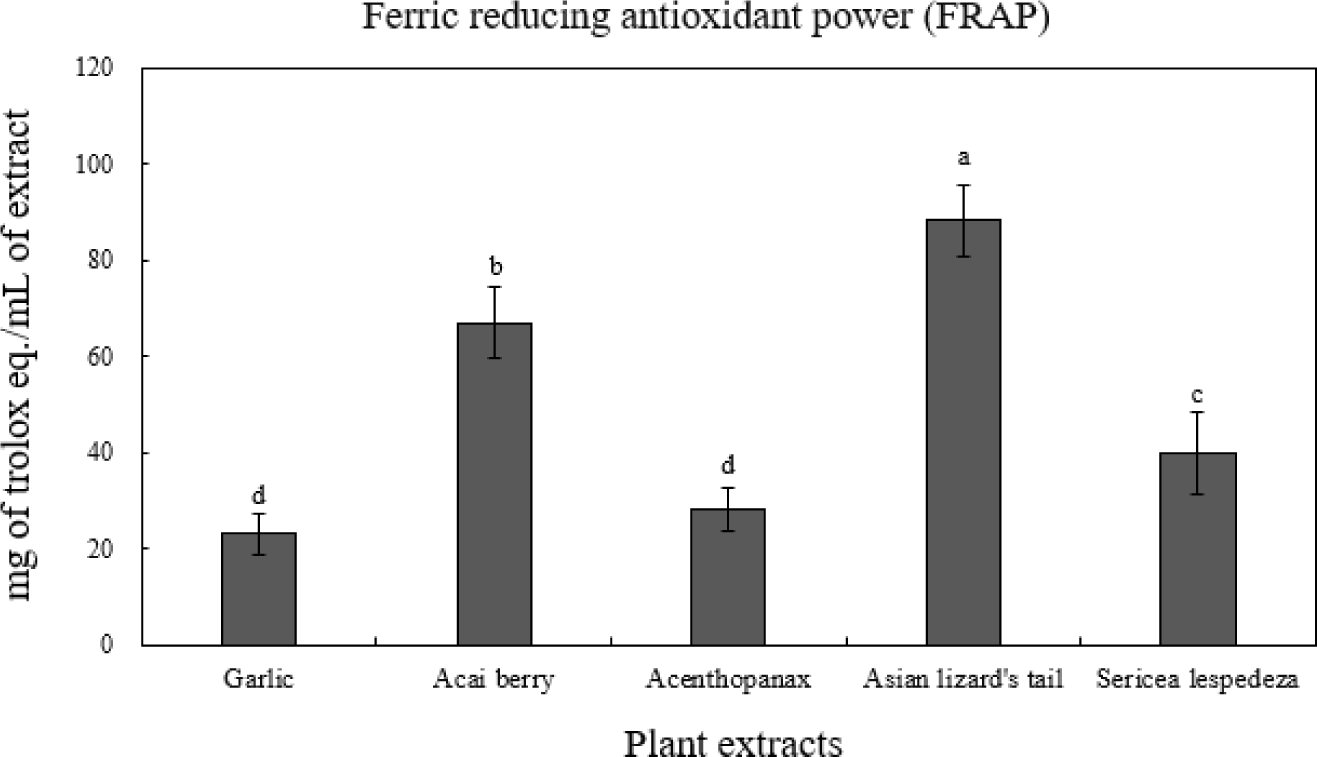
FRAP value의 측정은 낮은 pH 환경에서 환원물질에 의해 ferric tripyridyltriazine(Fe3+-TPTZ)이 파란색의 ferrous tripyridyltriazine(Fe2+ TPTZ)으로 환원되는 것을 이용한 측정법으로 환원력이 클수록 흡광도 값이 높게 측정된다(Gulcin 2020). 환원력은 활성산소 및 free radical에 전자를 공여하는 능력으로 DPPH radical 소거능, 페놀 함량 및 항산화 활성과 상관관계를 나타낸다고 보고되어 있다(Choi et al., 2007; Lee et al., 2011; Pérez-Fons L et al., 2010). 식물 5종 추출물의 환원력 측정결과를 Fig. 3에 나타내었다. 식물 추출물 중 삼백초(88.33 mg TE/mL)가 유의적으로 가장 높은 환원력을 보였으며, 아사이베리(67.61 mg TE/mL), 비수리(39.88 mg TE/mL), 오가피(28.30 mg TE/mL), 마늘(23.15 mg TE/mL)순으로 측정되었다(p<0.05). Jung 등(2020)의 삼백초 추출물의 항산화활성 측정연구에서 환원력을 측정한 결과 양성대조군인 vitamin C보다 현저히 높은 환원력을 보였다고 보고하여 본 연구와 일치하였다. 이는 DPPH 라디칼 소거 활성과 FRAP은 유리 라디칼 소거능을 이용하는 항산화 실험 방법(Lee et al., 2013)이기 때문에, DPPH 측정 결과와 유사하게 나타난 것으로 생각된다.
Fig. 3.
Ferric reducing antioxidant power(FRAP) of 5 plant extracts.
a-dMeans on bars with different letters are significantly different (p<0.05).
Download Original Figure
4. 총 페놀 함량
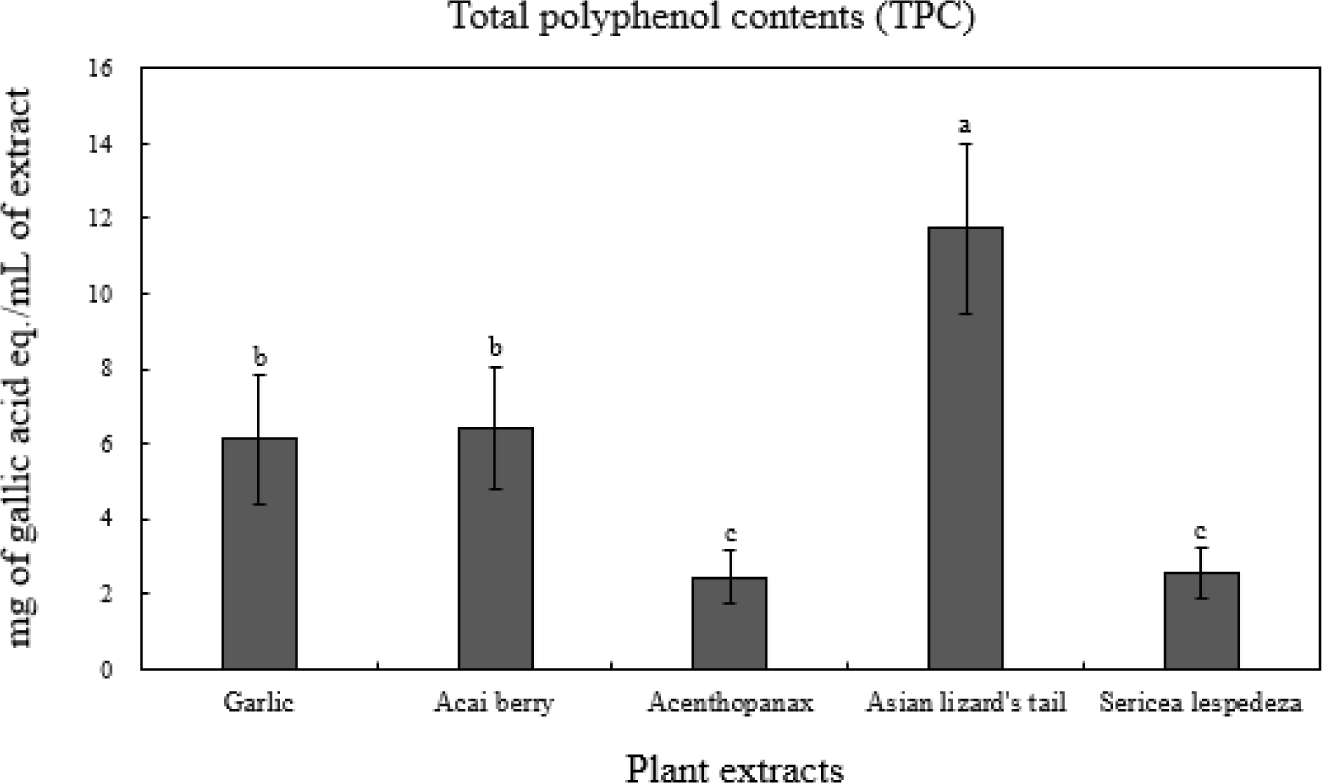
폴리페놀 화합물은 식물의 2차 대사산물로 1개 이상의 수산기가 치환된 벤젠환을 가지는 phenolic acid, flavonoid, condensed tannin과 같은 다양한 구조의 화합물을 말한다(Yu et al., 2006). 이러한 페놀성 화합물은 체내 항산화, 항염증과 같은 생리활성을 가지고 있으며, 금속이온을 흡착하는 구조로 이루어져 있어 높은 항산화능을 가지고 있다고 알려져 있다(Kandaswami and Middleton, 1994). 식물 5종 추출물의 총 페놀 함량 측정결과를 Fig. 4에 나타내었다. 식물 추출물 중 삼백초(11.76 mg GAE/mL)가 유의적으로 가장 높은 총 페놀함량을 보였으며, 아사이베리(6.40 mg GAE/mL), 마늘(6.14 mg GAE/mL), 비수리(2.58 mg GAE/mL), 오가피(2.44 mg GAE/mL) 순으로 측정되었다(p<0.05). Lee (2021)의 삼백초 용매분획물의 항산화활성 측정연구에 따르면, 삼백초의 메탄올 추출물에서 총 폴리페놀함량이 13.40 mg GAE/g으로 측정되어 본 연구와 일치하는 경향을 보였다. 또한 Cho(2014)는 삼백초의 페놀 화합물에 의하여 항산화, 고혈압 억제 및 통풍 억제 등의 생리활성이 발현되는 것이라고 보고하였다.
Fig. 4.
Total polyphenol contents(TPC) of 5 plant extracts.
a-cMeans on bars with different letters are significantly different (p<0.05).
Download Original Figure
5. 총 플라보노이드 함량
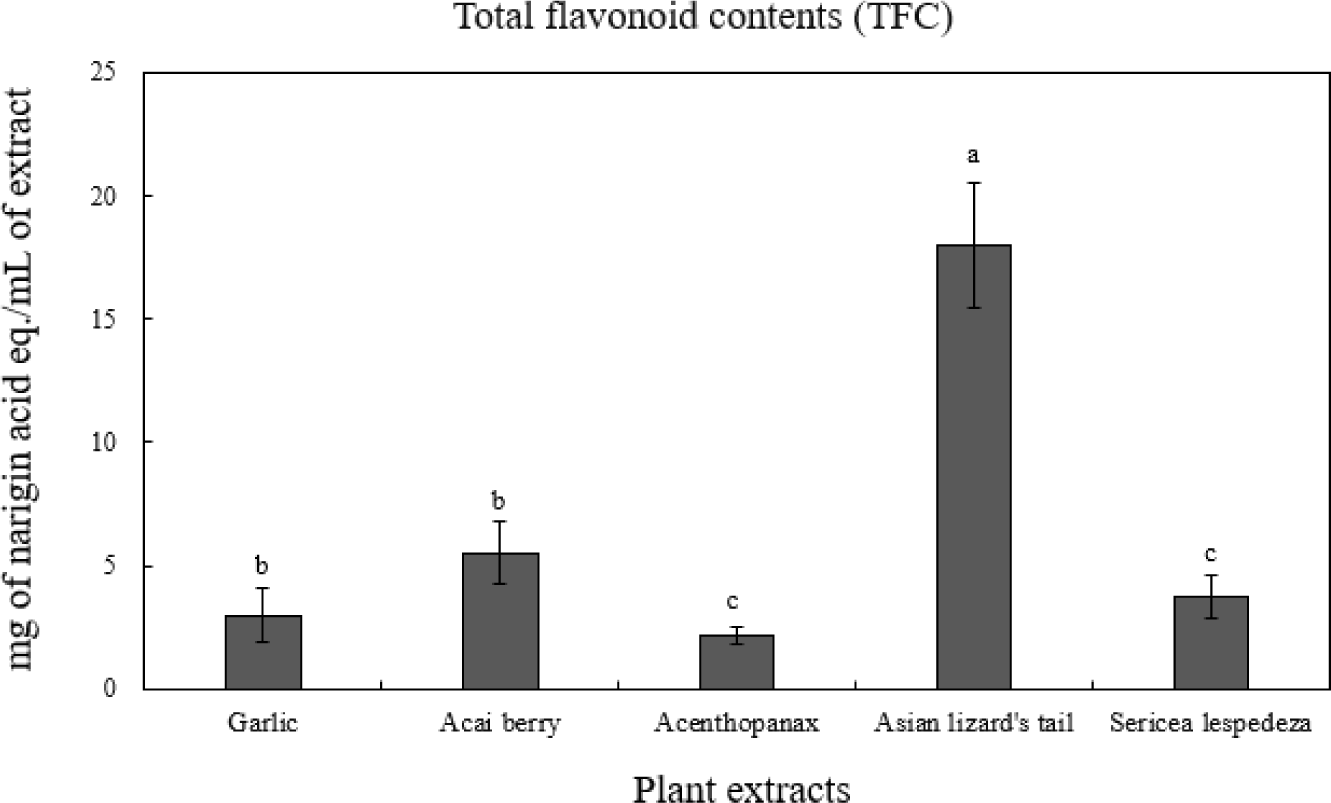
현재까지 플라보노이드는 약 4,000종 이상이 알려져 있으며, 담황색 또는 노란색을 띄는 색소 화합물로 식물 중에는 대부분 당과 결합된 배당체형태로 존재한다(Hertog et al., 1992). 폴리페놀과 함께 대표적인 생리활성물질인 플라보노이드는 두개의 벤젠고리와 헤테로 사이클릭 고리로 구성된 것을 기본형으로 quercetin, catechin, isoflavone 등이 알려져 있다(Kim, 2016). 플라보노이드는 세포 내 lipoxygenase 활성에 의하여 산화 생성물 및 자유라디칼 생성 속도 저해, 염증 반응 저해 및 억제 등 다양한 효과를 나타내는 것으로 알려져 있다(Hu et al., 2006; Moutsatsou, 2007). 5종 추출물의 총 플라보노이드 함량 측정결과를 Fig. 5에 나타내었다. 식물 추출물 중 삼백초(17.98 mg NE/mL)가 유의적으로 가장 높은 총 플라보노이드 함량을 보였으며, 아사이베리(5.51 mg NE/mL), 비수리(3.71 mg NE/mL), 마늘(2.98 mg NE/mL), 오가피(2.16 mg NE/mL) 순으로 측정되었다(p<0.05). Skotti 등(2014)은 다양한 약용식물의 총 페놀 함량, DPPH 및 ABTS 간의 상관성 연구에서 높은 양의 상관관계가 있음을 보고하였으며, Sánchez-González 등(2005)은 페놀, 플라보노이드의 함량과 FRAP value 간의 높은 양의 상관관계를 가지고 있다고 보고하여 본 연구결과와 일치하였다. 따라서 본 연구결과 페놀, 플라보노이드 함량이 많은 삼백초에서 높은 라디칼 소거능, 환원력을 나타낸 것으로 사료된다.
Fig. 5.
Total flavonoid contents(TFC) of 5 plant extracts.
a-cMeans on bars with different letters are significantly different (p<0.05).
Download Original Figure
Ⅳ. 요 약
본 연구는 항산화 능력이 뛰어난 식물 5종(마늘, 아사이베리, 오가피, 삼백초, 비수리)의 항산화 활성을 평가하고자 실시하였다. 식물 5종의 추출물은 감압농축하여 동결건조 후 실험에 사용하였으며, ABTS+ 라디칼 소거능, DPPH 라디칼 소거능, 환원력(FRAP), 총 페놀 함량, 총 플라보노이드 함량을 분석하였다. ABTS+, DPPH 라디칼 소거능 측정결과 삼백초 추출물의 소거능이 80.58%, 75.29%로 식물 5종 추출물 중 가장 높은 소거능을 나타내었다(p<0.05). 환원력 측정결과 삼백초(88.33 mg TE/mL)가 유의적으로 가장 높은 환원력을 보였으며, 아사이베리(67.61 mg TE/mL), 비수리(39.88 mg TE/mL), 오가피(28.30 mg TE/mL), 마늘(23.15 mg TE/mL) 순으로 측정되었다(p<0.05). 총 페놀, 총 플라보노이드 함량 측정결과 삼백초가 각각 11.76 mg GAE/mL, 17.98 mgNE/mL로 식물 5종 추출물 중 가장 높은 함량을 나타내었다(p<0.05). 이러한 연구결과를 바탕으로 삼백초는 합성 항산화제를 대체하는 천연 항산화제로서 활용될 수 있을 것으로 생각되며, 세포배양액에서 천연 항산화제로 개발가능성이 있는 소재를 제시할 수 있을 것으로 생각된다. 또한 추후 연구에서 식품 첨가에 따른 항산화 지속성 및 관능적 특성변화 분석을 통하여 식품산업적으로 활용이 가능할 것으로 사료된다.
Ⅴ. 감사의 글
본 연구는 한국연구재단(과제번호: RS-2024-00460285) 2024년 Post-Doc. 성장형 공동연구 지원사업의 지원을 받아 수행되었으며, 이에 감사드립니다.
Ⅵ. 참고문헌
Bondet V, Brand-Williams W, Berset C. 1997. Kinetics and mechanisms of antioxidant activity using the DPPH Free radical method. LWT Food Sci Technol 30:609-615.


Choi YM, Jeong HS, Lee, JS. 2007. Antioxidant activity of methanolic extracts from some grains consumed in Korea. Food Chem 103:130-138.


Choi MH, Shin HJ. 2015. Anti-oxidative and anti-melno genesis effects of buleberry extract. Kor J Aesthet Cosmetol 13:261-266.

Hertog MG, Hollman PC, Katan MB. 1992. Content of potentially anticarcinogenic flavonoids of 28 vegetables and 9 fruits commonly consumed in the Netherlands. J Agri food chem 40:2379-2383.


Jeong HM, Kim YS, Ahn SJ, Auh MS, Ahn JB, Kim KY. 2011. Effects of
Zizyphus jujuba var.
boeunesis extracts on the growth of intestinal microflora and its antioxidant activities. J Korean Soc Food Sci Nutr 40:500-508.


Jeong SJ, Shim HR, Lee JS, Nam HS, Lee HG. 2015. Antioxidant and synergistic activities of fruit and vegetable concentrates. Korean J Food Sci Technol 47:240-245.


Jo YJ. 2014. Antioxidant, angiotensinconverting enzyme and xanthin oxidase inhibitory activity of extracts from
Saururus chinensis leaves by ultrafine grinding. Food Sci Preserv 21:75-81.


Kang JR, Kang MJ, Choi MH, Byun HU, Shin JH. 2017. Physicochemical characteristics of ethanol extract from
Artemisia argyi H. using different preparation methods. J Life Sci 27:23-31.


Kim EJ, Choi JY, Yu M, Kim MY, Lee S, Lee BH. 2012. Total polyphenols, total flavonoid contents, and antioxidant activity of Korean natural and medicinal plants. Korean J Food Sci Technol 44:337-342.


Kim EY, Baik IH, Kim JH, Kim SR, Rhyu MR. 2004. Screening of the antioxidant activity of some medicinal plants. Korean J Food Sci Technol 333-338.

Kim H, Park S, Lee G, Lee DS, Lee J. 2024. Antioxidant and anti-inflammatory activities of root vegetable mixture extract. Korean J Community Living Sci 35:265-275.


Kim HR. 2016. Optimization of polyphenol extraction from fruit and non-edible parts of
Aronia melanocarpa and biological activity evaluation. Master’s thesis, Hoseo Univ. Asan, Korea.

Lee JB, Park HK, Lee JS, Kim MH. 2011. Studies on antioxidant activity, total flavonoids and polyphenols, and reducing power in Yakju with different ratios of dandelion root. J East Asian Soc Diet Life 21:882-887.

Lee YJ, Kim DB, Cho JH, Baik SO, Lee OH. 2013. Physicochemical characteristics and antioxidant activity of bio resource juices from Jeju. Korean J Food Sci Technol 45:293-298.


Lee YR. 2021. Antioxidative and
α-glucosidase inhibition activity of extracts fraction from
Saururus chinensis Baill. Korean J Food & Nutr 34:289-294.

Moutsatsou P. 2007. The spectrum of phytoestrogens in nature: Our knowledge is expanding. Hormones (Athens) 6:173-193.

Pérez-Fons L, GarzOn MT, Micol V. 2010. Relationship between the antioxidant capacity and effect of rosemary
(Rosmarinus officinalis L.) polyphenols on membrane phospholipid order. J Agric Food Chem 58:161-171.



Sánchez-González I, Jiménez-Escrig A, Saura-Calixto F. 2005.
In vitro antioxidant activity of coffees brewed using different proce dures (Italian, espresso and filter). Food Chem. 90:133-139.


Shin JH, Lee HG, Kang MJ, Lee SJ, Sung NJ. 2010. Antioxidant activity of solvent fraction from black garlic. J Korean Soc Food Sci Nutr 39:933-940.


Skotti E, Anastasaki E, Kanellou G, Polissiou M, Tarantilis PA. 2014. Total phenolic content, antioxidant activity and toxicity of aqueous extracts from selected Greek medicinal and aromatic plants. Ind Crops Prod 53:46-54.


Son JW, Ko SN, Kwon HW. 2024. Antioxidantion, antimicrobial and antithrombosis activities of natural products. Ind Promot Res 9:143-151.

Suh J, Paek OJ, Kang YW, Ahn JE, Yun J, Oh KS, An YS, Park SH, Lee SJ. 2013. Study on the antioxidant activity in the various vegetables. J Fd Hyg Safety 28:337-341.


Yang HS, Hwang IG, Choi AJ, Choe JS. 2023. Neuroprotective effect of Deodeok (
Codonopsis lanceolata) bud extracts in H
2O
2-stimulated SH-SY5Y cells. J Nutr Health 56:140-154.


Yu MH, Im HG, Lee HJ, Ji YJ, Lee IS. 2006. Components and their antioxidant activities of methanol ex tracts from sarcocarp and seed of
Zizyphus jujuba var.
inermis Rehder. Korean J Food Sci Technol 38:128-134.