I. 서 론
대두(Glycine max)의 유지 가공 부산물인 대두박(soybean meal)은 평균 45% 이상의 단백질을 함유하여 펩타이드 및 아미노산의 산업적 생산을 위한 유용 자원으로 활용되어 왔다(Zhang et al., 2024). 대두박에서 생산한 펩타이드는 라이신(lysine), 메티오닌(methionine) 및 트립토판(tryptophan) 등의 필수 아미노산을 풍부하게 포함하여 영양학적으로 가치가 우수하고, 구성 아미노산의 서열에 따라 특정 펩타이드는 항산화, 항고혈압 및 항균 등의 생리활성을 나타낸다고 알려져 있다(Yu et al., 2018). 최근 식품산업통계정보(Food information statistics system Nov 20, 2023)에 따르면 사료용 대두박의 가격은 2022년 대비 약 14% 상승함에 따라 이를 대체할 수 있는 박류 사료의 탐색 및 활용에 관한 연구가 필요한 실정이다(Garbacz et al., 2023). 이전의 연구에 따르면 들깨(Perilla frutescens)의 종자에서 유지를 추출하는 과정에서 발생하는 들깨박(perilla seed meal)과 건식 제분기술을 사용하여 옥수수에서 에탄올을 생산한 뒤 발생하는 옥수수 주정박(dried distillers grains with solubles)은 대두박을 대체할 수 있는 박류 사료 단백질 공급원으로 주목 받고 있다(Łukasiewicz et al., 2012; Oh et al., 2020).
일반적으로 박류 사료는 기호성과 가공 특성(용해도 등)이 낮고 잠재적인 항 영양인자와 알레르기 유발 물질을 포함하여 식품산업에서의 활용이 제한적이다(Fan et al., 2023). 이러한 박류 사료의 활용성을 개선하기 위하여 효소적 단백질 가수분해 기술이 산업적으로 활발히 적용되고 있다(Venuste et al., 2013). 효소적 가수분해는 고분자의 단백질을 저분자의 펩타이드 혹은 유리 아미노산으로 분해하여 소화 흡수율 개선에 따른 영양적 가치 향상, 단백질 용해도 증가에 의한 가공 특성 개선 및 항 알레르기성의 잠재적 감소 등을 기대할 수 있다(Tavano, 2013). 또한, 단백질 원료 특성 및 가수분해 조건(pH, 온도, 시간 및 효소 종류 등)에 따라 항산화 및 스트레스 저감 등 생리학적 이로움을 나타내는 유용 생리활성 물질의 생성이 가능하다(Sentís-Moré et al., 2022; Venuste et al., 2013).
단백질 가수분해 효소는 원료 단백질에 대한 절단 부위(cleavage site)가 다르기 때문에 최종 가수분해물의 가공적 및 기능적 특성을 결정하는 중요한 요인이다(Deng et al., 2018). 상용 효소인 Alcalase는 단백질의 펩타이드 사슬 중간 부위를 절단하여 항산화 활성이 우수한 생리활성 펩타이드 생산에 널리 활용되는 상용화된 endopeptidase의 하나이다. 또한, 동물의 단백질 소화 효소 중 하나인 트립신(trypsin)은 아르기닌(arginine) 혹은 라이신(lysine) 다음에 위치한 펩타이드 결합을 가수분해하는 endopeptidase이다. 이 두가지 효소는 반응 pH, 온도 및 시간 등의 가수분해 조건을 제어하여 가수분해도의 조절이 용이하기 때문에 현재 단백질 가수분해물 및 유용 펩타이드 생산에서 산업적으로 활용도가 우수하다(Zhang, 2020).
이전의 연구에 따르면 분자량이 5 kDa 이하인 저분자 펩타이드는 그 이상의 고분자 펩타이드와 비교하였을 때 우수한 항산화 활성을 나타낸다고 보고된 바 있다(Park et al., 2014). 실제로 Park과 Yoon(2018)은 들깨박 단백질을 7종의 단백질 가수분해효소로 처리하여 얻어진 한외여과 분획에서 분자량에 따라 항산화 활성의 차이가 나타난다고 보고하였다. 그러나 옥수수 주정박 유래 단백질 가수분해물의 항산화 특성과 관한 연구는 제한적이며, 앞서 언급한 바와 같이 주요 박류 사료에 속하는 대두박, 들깨박 및 옥수수 주정박 가수분해물의 항산화 특성을 비교한 연구는 전무한 실정이다. 따라서, 본 연구는 들깨박과 옥수수 주정박을 활용하여 항산화능을 나타내는 유용 단백질 가수분해물의 생산 가능성을 평가하고자 실시하였다. 특히, 대두박 가수분해물의 대체 효과를 평가하기 위하여 대두박, 들깨박 및 옥수수 주정박을 Alcalase 혹은 트립신으로 가수분해하여 가수분해 특성을 분석하고, 해당 단백질 가수분해물을 한외 여과하여 5 kDa 이하의 분획을 획득한 뒤 얻어진 박류 사료 단백질 가수분해물의 항산화 특성을 비교하였다.
Ⅱ. 재료 및 방법
본 연구에 사용된 대두박(단백질 함량 48%)은 국내 사료회사(IANS Co. Ltd., Korea)에서 제공받았으며, 들깨박(단백질 함량 36%)은 들기름 추출 과정에서 발생한 것으로 국내 들기름 생산회사(Keuireum Co. Ltd., Korea)에서 제공받았다. 옥수수 주정박(단백질 함량 29%)은 옥수수 주정 제조 과정에서 발생한 것으로 국내 사료회사(Hanjungss Co. Ltd., Korea)에서 구매하였다. 모든 시료는 PE/NY 진공 포장지에 포장하여 운송되었고, 실험에 사용하기 전까지 냉장 온도에 보관하였다.
박류 사료(대두박, 들깨박 및 옥수수 주정박)는 20%(w/v) 농도로 증류수에 혼합한 후 단백질 가수분해효소의 최적 활성을 위해 0.1 M NaOH를 사용하여 혼합물의 pH를 8.0으로 조절하였다. 공시재료인 대두박, 들깨박 및 옥수수 주정박 원물의 pH는 각각 6.55, 6.41 및 4.45를 나타내었다. 혼합물은 균질기(HG-15A, Daihan Sci., Korea)를 사용하여 10,000 rpm에서 2분간 균질하였고, Alcalase 2.4 L(EC 3.4.21.62, a declared activity 2.4 AU/kg, density 1.18 g/mL, Novozymes, Denmark)과 트립신(EC 3.4.21.4, trypsin from porcine pancreas, 1,000-2,000 BAEE units/mg solid, Sigma-Aldrich, USA)을 사용하여 효소적으로 가수분해하였다. 효소 대 기질의 비율(enzyme to substrate)은 시료의 단백질 함량에 대하여 1%(w/w)로 설정하였다. 효소적 가수분해 반응 조건은 Alcalase의 경우 50°C 및 트립신의 경우 37°C로 설정하였고, 해당 온도로 설정된 항온수조(JSIB-22T, JS Research Inc., Korea)에서 2시간 동안 가수분해를 진행하였다. 이후 가수분해 종료 및 효소 불활성화를 위해 85°C에서 20분간 가열하였다. 박류 사료 가수분해물은 실온에서 60분간 냉각한 뒤 시험용 체(크기 500 μm/35, 선 굵기 315 μm, 885705, CHUNG GYE SANG GONG SA, Korea)로 여과하여 불용성 분획을 제거하였다. 여액은 3,500 g, 4°C에서 20분간 원심분리하여 가용성의 상등액을 분리한 뒤 추가 분석을 위해 4°C 냉장에서 보관하였다.
분자량이 5 kDa 이하인 펩타이드 분획을 분리하기 위해 박류 사료 가수분해물은 한외여과막(Vivaspin 20 MWCO 5000, Sartorius stedim Lab Lid, UK)을 사용하여 3,500 g, 4°C에서 20분간 원심분리를 진행하였다. 얻어진 5 kDa 이하의 분획은 –70°C에서 동결한 이후 동결건조(80×10-3 Torr pressure, PVTFD10R, Ilshin Lab, Korea)를 진행하였고, 동결건조 및 분말화한 시료는 –20°C에서 보관하며 in vitro 항산화 활성 분석에 사용하였다.
박류 사료의 단백질 용해성은 Li 등(2013)의 방법을 응용하여 측정하였다. 시료 2 g은 0.1 M potassium phosphate 완충액 20 mL와 1.1 M Potassium iodide 완충액(pH 7.4)을 첨가 후 균질기를 이용하여 10,000 rpm으로 2분간 균질하였다. 균질한 시료를 3,500 g, 4°C에서 20분간 원심분리하고, 상층액은 여과지(Whatman no.4, Whatman International Ltd., England)에 여과한 후 Biuret법으로 단백질 농도를 측정하였다(Amiri et al., 2018). 시료의 단백질 농도는 bovine serum albumin(BSA, purity≥98%, Sigma-Aldrich, USA) 표준곡선을 활용하여 산출하였고, 단백질 용해성은 mg/g으로 나타내었다.
박류 사료의 효소적 가수분해 이후 가수분해도는 단백질 농도 측정을 기반으로 하는 Pierce™ BCA Protein Assay Kits(23225#, thermo scientific, USA) 표준 분석법에 의해 분석하였다(Park and Yoon, 2018). 가수분해물 2 mL에 20% trichloroacetic acid(TCA) 2 mL를 첨가하여 1,600 g, 20°C에서 30분간 원심분리한 뒤 상층액을 bicinchoninic acid(BCA)법에 따라 총 단백질량과 10% TCA 가용성 단백질량을 측정하였다. 시료의 단백질 농도는 BSA를 표준물질로 사용하여 측정한 표준곡선에 따라 환산하였고, 가수분해도는 다음 식을 이용하여 산출하였다.
박류 사료 가수분해물 유래 5 kDa 이하 분획의 DPPH 라디칼 소거 활성은 Chen 등(2012)의 방법을 응용하여 실시하였다. 99.9% ethanol에 용해된 0.1 mM DPPH 용액 100 μL를 동량의 시료(1 mg/mL)와 혼합하였다. 혼합물은 25°C에서 30분 동안 반응 후 마이크로 플레이트 리더(Infinite M200 PRO, Tecan, Austria)를 사용하여 515 nm에서 흡광도를 측정하였다. Ablank는 에탄올과 시료를 1:1로 혼합하여 흡광도를 측정한 값이며, Acontrol은 DPPH 시약과 증류수를 1:1로 혼합하여 흡광도를 측정한 값이다. 대조군은 동일 농도의 L-ascorbic acid(PHR1008, Sigma-Aldrich, USA)를 사용하였다. DPPH 라디칼 소거능은 다음 수식을 이용하여 계산하였다.
박류 사료 가수분해물 유래 5 kDa 이하 분획의 ABTS 양이온 라디칼 소거 활성은 Cui 등(2022)의 방법을 응용하여 실시하였다. 7 mM ABTS에 2.45 mM potassium persulfate를 첨가하여 ABTS 라디칼을 제조한 뒤 사용 전 실온의 암실에서 16시간 동안 보관하였다. 이후 spectrophotometer(Libra S22, Biochrom, UK)를 사용하여 ABTS 라디칼 용액의 흡광도가 734 nm에서 0.7±0.02가 되게끔 증류수로 희석하여 사용하였다. 40 μL의 희석 시료(1 mg/mL)는 ABTS 라디칼 용액 5 mL와 혼합한 이후 6분 동안 암실에서 반응하였다. 이후 반응물의 흡광도는 734 nm에서 측정하였다. Ablank는 시료 대신 증류수를 혼합하여 측정한 흡광도 값이며, Asample은 ABTS 라디칼 용액과 시료를 반응시켜 얻어진 흡광도 값을 나타낸다. 대조군은 동일 농도의 L-ascorbic acid를 사용하였다. ABTS 라디칼 소거능은 다음 수식을 이용하여 계산하였다.
박류 사료 가수분해물 유래 5 kDa 이하 분획의 환원력은 Athukorala 등(2006)의 방법을 응용하여 실시하였다. 25 mg/mL의 농도로 증류수에 용해된 시료 0.25 mL를 0.25 mL의 0.2 M phosphate buffer(pH 6.6) 및 0.25 mL의 1%(w/v) potassium ferricyanide를 혼합한 이후 50°C 항온수조에서 20분 동안 반응하였다. 반응물에 10%(w/v) TCA 0.25 mL를 첨가한 후 0.25 mL를 분취하여 증류수 0.25 mL 및 0.1% ferric chloride 2 mL와 혼합하였다. 이후 37°C에서 10분간 반응 후 spectrophotometer를 사용하여 700 nm에서 흡광도를 측정하였다. 환원력은 시료 간의 흡광도 값의 차이로 나타내었으며, 대조군은 5 mg/mL 농도의 L-ascorbic acid의 환원력을 동일한 방법으로 측정하여 나타내었다.
박류 사료 가수분해물 유래 5 kDa 이하 분획의 총 폴리페놀 함량은 Folin 분석을 사용하여 분석하였다(Aoshima and Ayabe, 2007). 1 mL의 희석 시료(1 mg/mL)를 Folin-Ciocalteu(F9252, Sigma-Aldrich, USA) 1 mL와 혼합 후 10%(w/w) sodium carbonate solution 1 mL를 혼합물에 첨가하였다. 혼합물은 실온에서 1시간 반응한 뒤 spectrophotometer를 사용하여 700 nm에서 흡광도를 측정하였다. 시료의 총 폴리페놀 함량은 표준물질인 gallic acid의 표준 정량곡선을 활용하여 산출하였고, 시료 건조 중량 mg당 gallic acid 당량(μg GAE/mg)으로 표시하였다.
Ⅲ. 결과 및 고찰
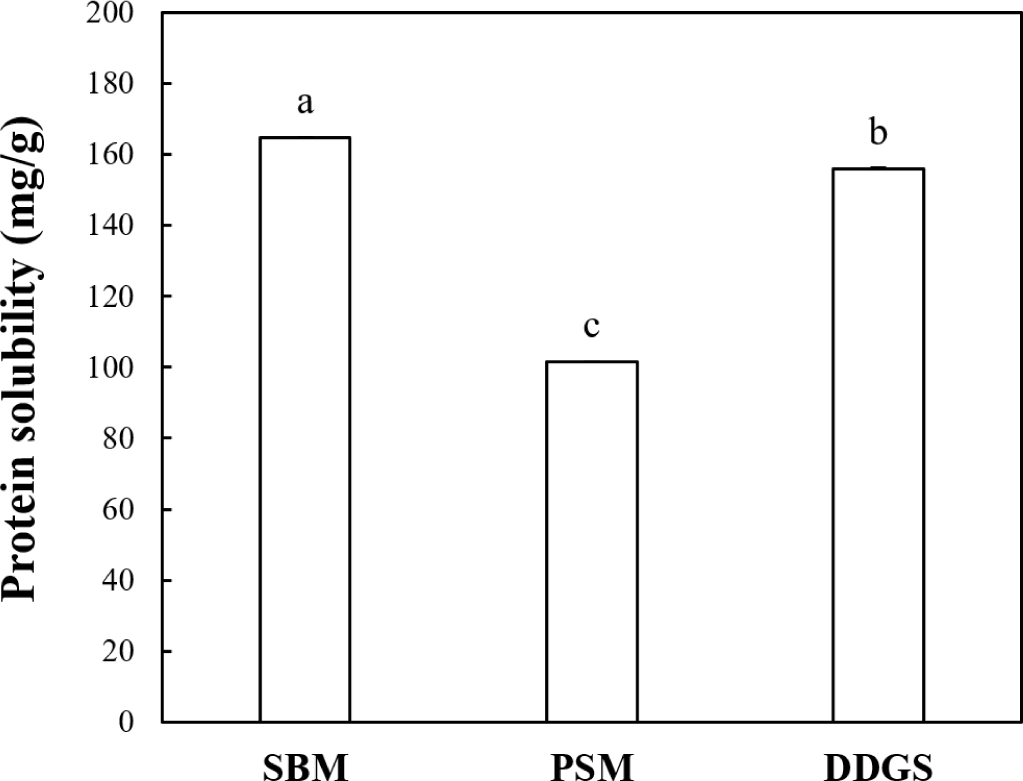
박류 사료(대두박, 들깨박 및 옥수수 주정박)의 단백질 용해성은 Fig. 1에 나타내었다. 가수분해 및 불활성화를 마친 시점에서 대두박, 들깨박 및 옥수수 주정박 혼합물의 pH는 Alcalase 가수분해물에서 각각 6.61, 6.07 및 4.47로 측정되었고, 트립신 가수분해물에서 각각 6.35, 6.02 및 4.27을 나타내었다. 박류 사료의 종류에 따라 단백질 용해성의 유의적인 차이가 나타났다. 대두박은 164.8 mg/g으로 가장 높은 단백질 용해성을 나타낸 반면, 들깨박은 101.6 mg/g으로 가장 낮은 수치를 나타내었다(p<0.05). 이전의 연구에 의하면 들깨박은 약 40%의 지방 함량 중 지용성의 리놀레산(linoleic acid)이 지방산 조성의 70% 이상을 차지하지만(Park et al., 1990), 대두박과 옥수수 주정박의 지방 함량은 각각 18% 및 9% 수준이다(Dozier et al., 2011, Liu and Rosentrater, 2012). 따라서, 유지 추출 이후 추가적인 탈지 공정을 거치지 않는 경우 일부 지질 성분이 잔존하여 들깨박에서 낮은 단백질 용해성을 나타낸 것으로 추측된다. 이전의 연구에서 탈지 및 에탄올 추출 공정은 들깨박의 단백질 용해성을 증가시켜 가수분해 효율과 항산화 효과를 증진한다고 보고된 바 있다(Kim et al., 1994). 효소적 가수분해 공정의 단백질 가수분해 정도는 단백질 원료의 용해성에 큰 영향을 받는다. 일반적으로 단백질 가수분해 공정은 수용액 상에서 진행되므로 물에 용해되는 능력을 의미하는 단백질 용해성은 효소와 기질의 반응성에 직접적인 영향을 미친다(Tavano, 2013). 특히, 불용성 또는 용해성이 낮은 단백질 원료는 응집체(aggregates) 및 침전물(precipitates)을 형성하여 단백질 가수분해를 제한할 수 있다(Zhang et al., 2023).
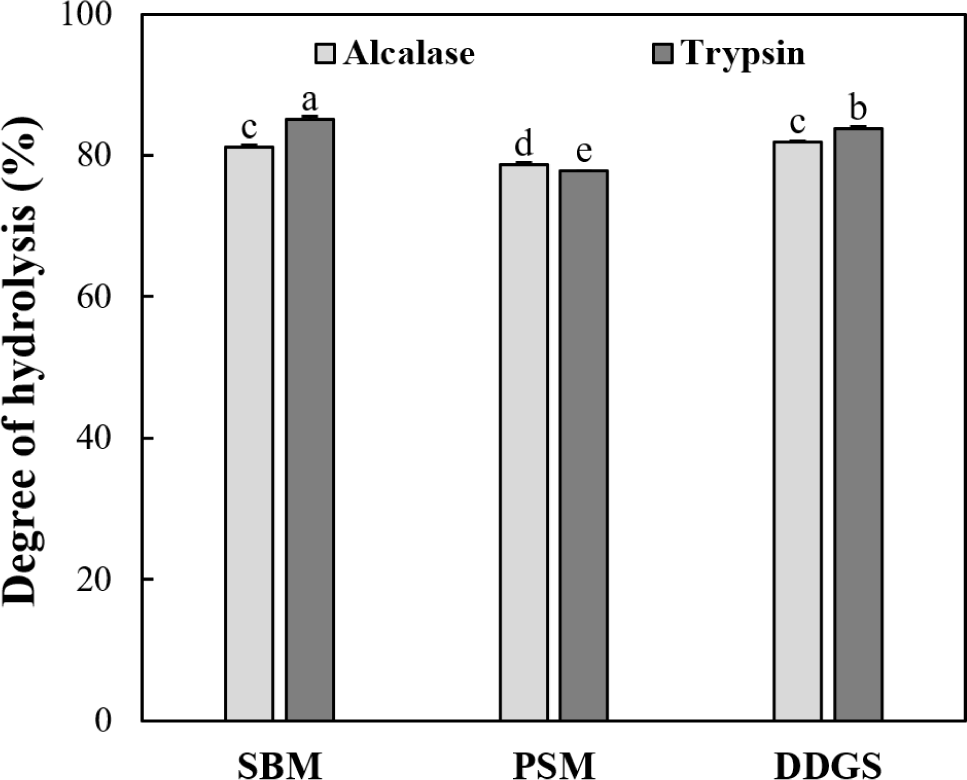
단백질 원료의 특성(단백질 용해성 등), 단백질 가수분해 효소 종류 및 가수분해 조건(효소 대 기질 비율, 온도, 시간 및 pH 등)은 가수분해 효율과 가수분해물의 생리활성에 영향을 미치는 주요 요인이다(Venuste et al., 2013). 박류 사료의 단백질 가수분해도는 Fig. 2에 나타내었다. 대두박, 들깨박 및 옥수수 주정박의 단백질 가수분해도는 77.78-83.81% 수준이었고, 박류 사료 종류 및 단백질 가수분해효소에 따른 가수분해도의 유의적 차이가 나타났다. 특히, 들깨박은 대두박과 옥수수 주정박에 비하여 낮은 가수분해도를 나타내었다(p<0.05). 이는 단백질 용해성(Fig. 1)에서 언급한 바와 같이 들깨박의 낮은 단백질 용해성에 의한 결과로 사료된다. 들깨박에서 Alcalase의 가수분해도가 트립신의 가수분해도보다 높은 반면, 대두박과 주정박에서는 Alcalase의 가수분해도보다 트립신이 높은 가수분해도를 나타내었다(p<0.05). 일반적으로 식물체에는 트립신 억제제(trypsin inhibitor)가 존재하기 때문에 트립신 처리 시 가수분해도의 저하가 발생할 것으로 예상하였으나, 대두박과 옥수수 주정박은 트립신을 처리한 경우 Alcalase보다 높은 가수분해도를 나타내었다(p<0.05). 이전의 연구에 의하면 박류 사료의 발생 과정 중 60°C 이상의 열처리 공정은 트립신 억제제를 불활성화 한다고 보고된 바 있다(Avilés-Gaxiola et al., 2018). 따라서, 박류 사료를 트립신 처리하여 가수분해물을 생산하는 경우, 트립신 억제제의 불활성을 유도할 수 있는 적절한 열처리 공정이 가수분해 효율에 큰 영향을 미칠 수 있다고 사료된다.
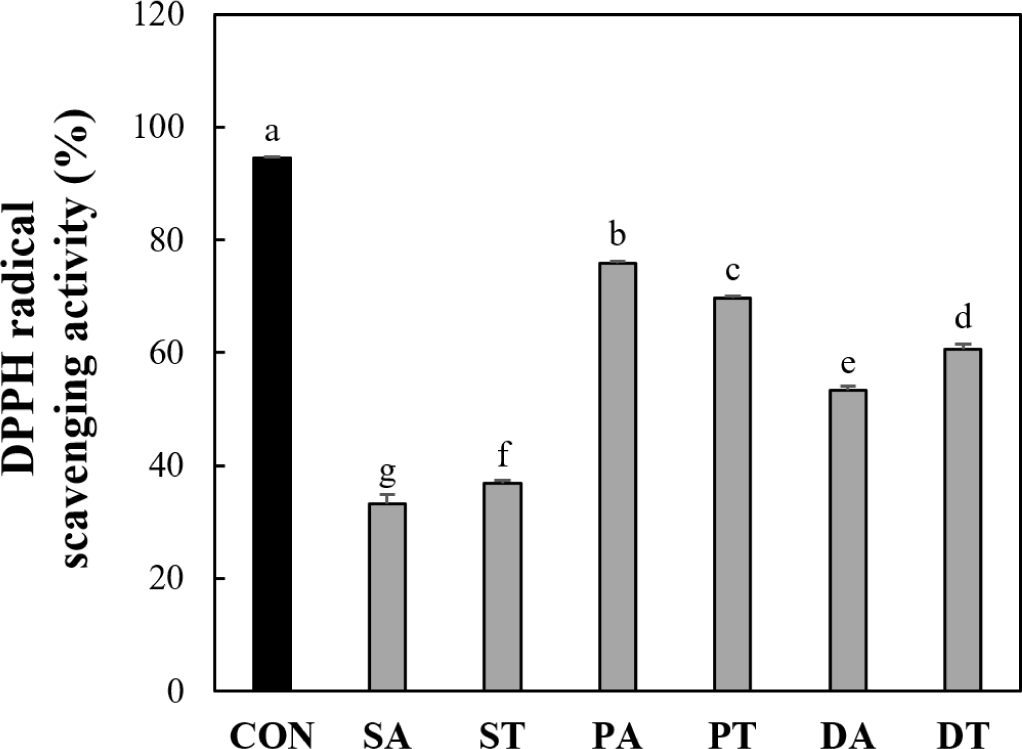
박류 사료 가수분해물 유래 5 kDa 이하 분획의 DPPH 라디칼 소거능은 Fig. 3에 나타내었다. DPPH 라디칼은 항산화제와 같은 양성자 공여 물질과 반응하여 라디칼 활성을 잃고, 그 결과 특정 파장(약 515nm)에서 흡광도가 감소하는 특징이 있으며, 빠르고 편리하며 재현성이 우수하다는 장점 때문에 단백질 가수분해물의 항산화 활성을 평가하는데 널리 사용한다(Yamamoto and Kajimoto, 1980; Jao and Ko 2002). 양성 대조군으로 사용한 L-ascorbic acid의 DPPH 라디칼 소거능은 94.56%로 유의적으로 가장 높은 활성을 나타내었다. 다음으로 들깨박을 Alcalase 및 트립신 처리한 가수분해물 유래 분획은 각각 75.88% 및 69.70%의 DPPH 라디칼 소거능을 나타내어 대두박 및 옥수수 주정박 가수분해물 유래 분획과 비교하여 유의적으로 높은 활성을 보였다. 이전 연구에 따르면 알칼리성 단백질 가수분해효소로 처리한 들깨박 가수분해물의 저분자 분획은 0.5 mg/mL의 농도에서 87.7%의 DPPH 라디칼 소거능을 나타내었다(Yang et al., 2018). 또한 Kim 등(2019)의 연구에 따르면 트립신으로 가수분해한 들깨박 가수분해물의 3 kDa 이하 분획은 0.1 mg/mL에서 36.89%의 DPPH 라디칼 소거능을 나타내었으며, 이러한 높은 소거능은 3 kDa 이하의 낮은 분자량과 leucine, isoleucine, proline 및 serine을 포함한 특정 아미노산의 존재에 기인한다. 이와 유사하게 Kim과 Yoon(2020)의 연구에서 들깨박의 트립신 가수분해물의 DPPH 라디칼 소거능을 가수분해 시간별로(0-6시간) 측정한 결과, 시간에 따른 변화가 관찰되기는 하였으나, 1시간 이후에는 유의적인 차이가 없었다. 이러한 이전의 연구를 통해 들깨박 가수분해물의 DPPH 라디칼 소거능은 가수분해 반응조건과 얻어진 분획의 크기에 의해 영향을 받지만, Kim 등(2019)의 연구에서 언급한 바와 같이 저분자 펩타이드들이 주로 들깨박의 DPPH 라디칼 소거능에 기여를 한다고 추정된다.
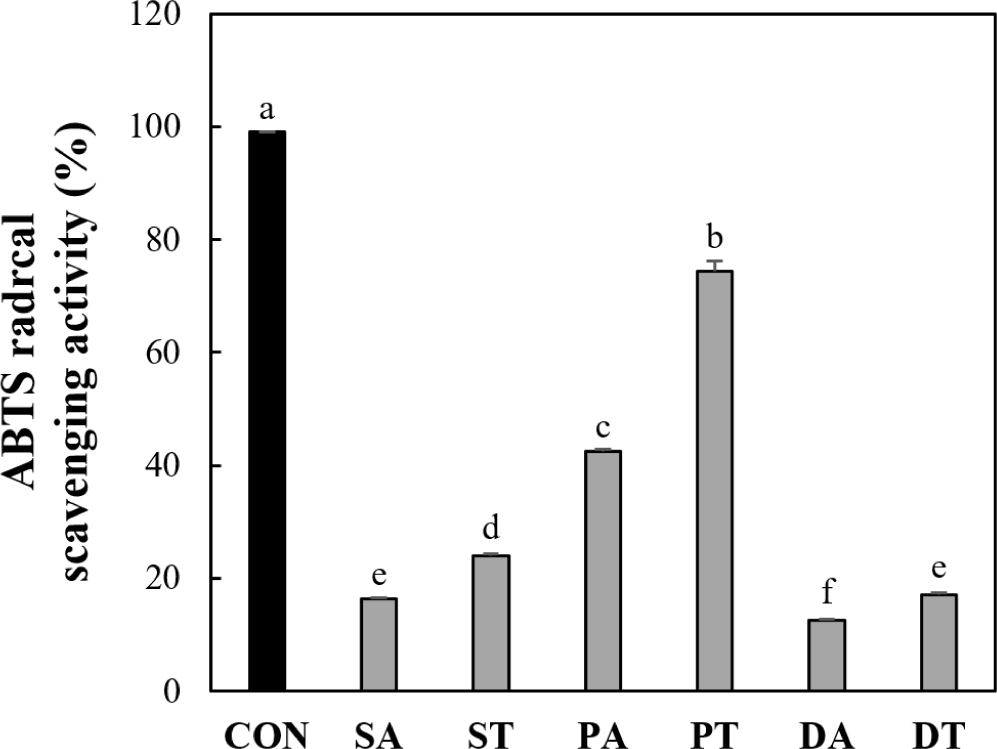
박류 사료 가수분해물 5 kDa 이하 분획의 ABTS 라디칼 소거능은 Fig. 4에 나타내었다. ABTS 라디칼 소거 분석은 친유성 및 친수성 화합물 모두에 적용 가능하며 항산화 활성 평가에 널리 사용한다(Dryáková et al., 2010). 양성 대조군으로 사용된 L-ascorbic acid는 99.01%의 항산화 활성을 나타내었다. 모든 박류 사료 가수분해물 분획에서 Alcalase보다 트립신에서 유의적으로 높은 ABTS 라디칼 소거능이 나타났다. 이러한 결과는 이전의 Kim과 Yoon(2020)의 연구에서 들깨박을 트립신으로 가수분해한 가수분해물의 IC50값이 139.85 μg/mL로 들깨박 Alcalase 가수분해물의 IC50값인 166.76 μg/mL보다 높은 ABTS 라디칼 소거능을 보인 결과와 유사하다. 트립신에 의해 가수분해된 들깨박 분획의 ABTS 라디칼 소거능은 74.35%로 대두박과 옥수수 주정박 가수분해물 분획에 비하여 높은 수치를 나타내었다(p<0.05). 이전 연구에 따르면 들깨박을 트립신으로 가수분해한 가수분해물을 200배 희석한 농도에서 85.53%로 높은 ABTS 라디칼 소거 활성을 보였으며, 이는 본 연구의 결과와 유사하다(Kim and Yoon, 2020).
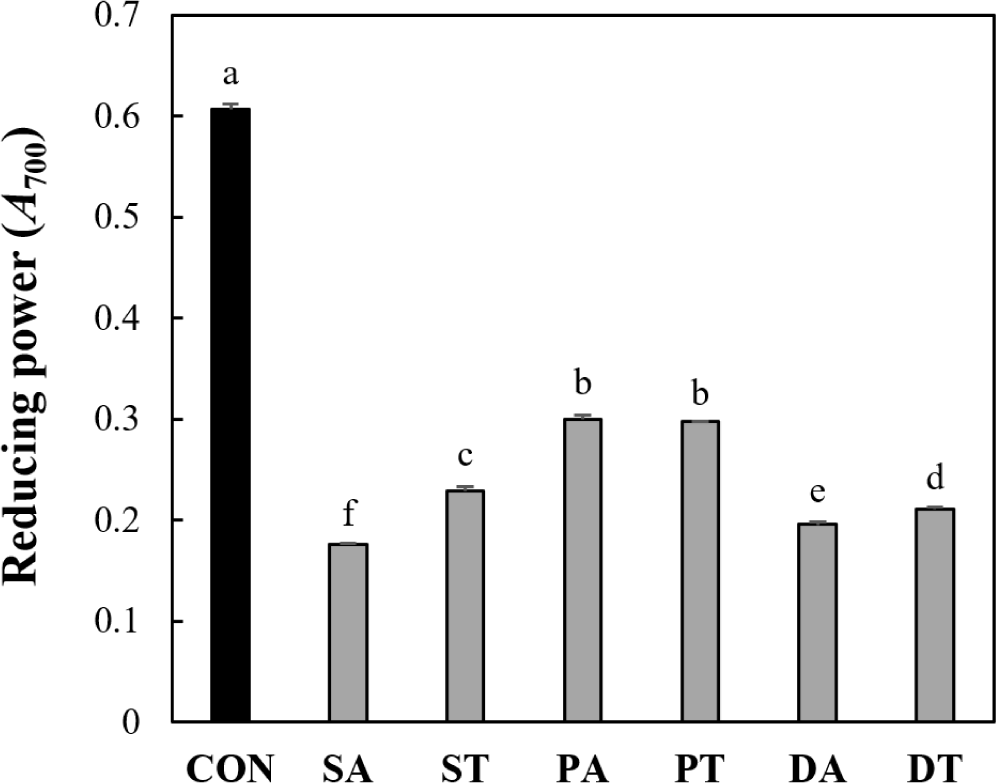
박류 사료 가수분해물 5 kDa 이하 분획의 환원력은 Fig. 5에 나타내었다. 환원력 분석은 천연 항산화제가 전자나 수소를 공여하는 능력을 평가하는 데 사용되며, 환원력이 우수할수록 700 nm에서 흡광도 값이 높아지는 특성이 있다(Duh, 1998; Xie et al., 2008). 양성 대조군으로 사용한 L-ascorbic acid는 0.61의 환원력을 나타내었다. 들깨박의 Alcalase와 트립신 가수분해물 분획에서 각각 0.3, 0.29로 유의적인 차이가 없었으나, 대두박과 옥수수 주정박의 Alcalase 가수분해물 분획이 트립신 가수분해물 분획보다 유의적으로 높은 환원력을 나타내었다. 이는 Zhao 등(2012)의 쌀겨 단백질 가수분해물 중 트립신이 Alcalase보다 더 높은 환원력을 나타낸 연구결과와 유사하다. 이러한 결과는 가수분해 조건 중 효소의 종류에 의한 특정 펩타이드 조성이 환원력에 크게 영향을 미침에 기인할 수 있다. 들깨박 가수분해물 분획은 대두박과 옥수수 주정박의 가수분해물 분획보다 유의적으로 높은 환원력을 나타내었다. Kim과 Yoon(2021)의 연구에 따르면 대조군으로 사용한 Trolox 및 BHT(butylated hydroxytoluene)의 환원력이 0.4 및 0.26으로 나타난 것에 비하여 들깨박을 트립신으로 가수분해한 가수분해물의 3 kDa이하 분획에서 0.56의 높은 환원력을 나타내었다. 이러한 결과는 본 연구의 Fig. 4와 Fig. 5에서 나타났던 들깨박의 뛰어난 항산화 활성과 유사한 경향이 나타나, 들깨박이 대두박의 단백질 사료 대체원으로 활용됨과 동시에 우수한 항산화능을 기대할 수 있음을 확인하였다.
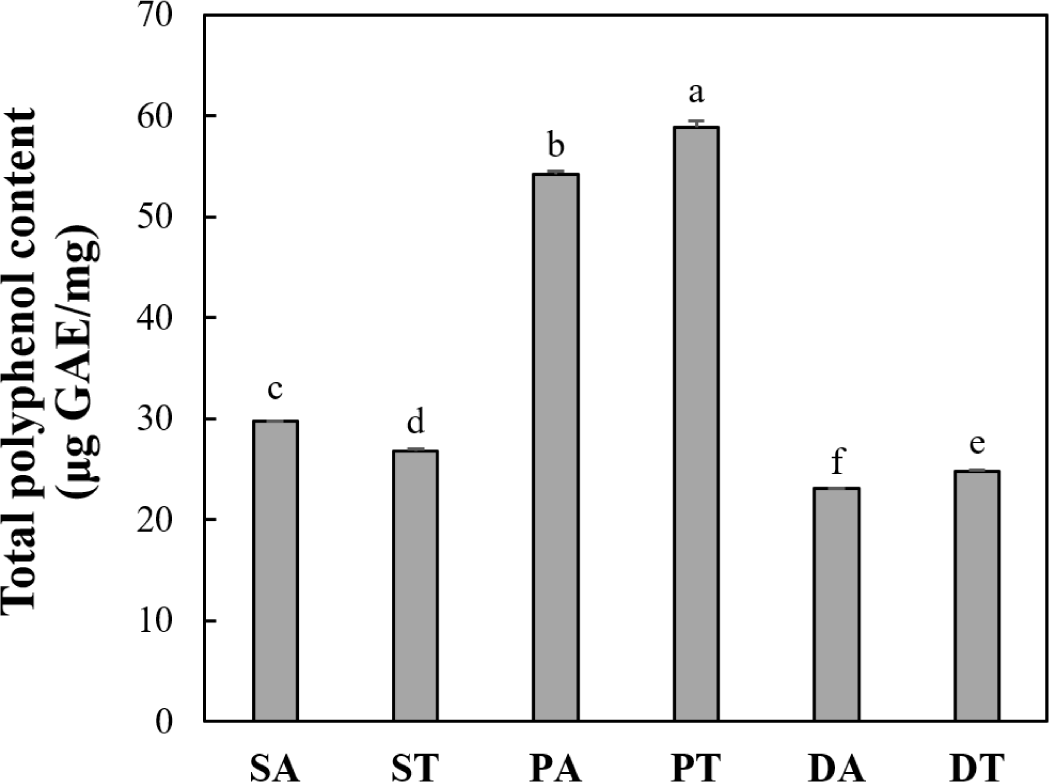
박류 사료 가수분해물 5 kDa 이하 분획의 총 폴리페놀 함량은 Fig. 6에 나타내었다. 대두박 Alcalase, 대두박 트립신, 옥수수 주정박 Alcalase 및 옥수수 주정박 트립신의 가수분해물 분획에서 각각 29.77, 26.77, 23.13 및 24.79 μg GAE/mg으로 낮은 폴리페놀 함량을 나타낸 반면, 들깨박 트립신과 들깨박 Alcalase 가수분해물 분획에서 각각 58.83 및 54.210 μg GAE/mg으로 높은 폴리페놀 함량 을 나타내었다(p<0.05). 식물의 폴리페놀은 하나 이상의 방향족 고리에 결합하는 하나 이상의 수산기를 특징으로 하는 2차 대사산물이다(Zhou et al., 2019). 많은 연구에서 식물의 폴리페놀이 다양한 산화 스트레스 유발 질병에 대한 항산화제로 사용될 수 있음이 밝혀짐에 따라 들깨박 가수분해물 분획의 높은 폴리페놀 함량은 항산화 활성에 영향을 미칠 수 있다(Stagos, 2019). 따라서 가수분해물 제조 공정 유래 생리활성 펩타이드의 항산화 활성 효과를 기대할 수 있으나, 폴리페놀 등의 가용성 항산화 물질들이 함께 혼입되는 경우가 발생할 수 있음을 확인하였다. 추후 연구에서는 박류 사료 단백질 유래 가수분해물에서 생리활성이 우수할 것으로 기대되는 펩타이드를 분리 및 정제하여 항산화 특성 등의 생리 기능적 효과를 직접 평가할 필요가 있다고 사료된다.
Ⅳ. 요 약
본 연구는 대두박 가수분해물의 대체 효과를 평가하기 위하여 들깨박 및 옥수수 주정박을 Alcalase 혹은 트립신으로 가수분해하여 가수분해 특성을 분석하고, 해당 단백질 가수분해물을 한외여과하여 5 kDa 이하의 분획을 획득한 뒤 얻어진 박류 사료 단백질 가수분해물 분획의 항산화 특성을 비교하였다. 박류 사료의 단백질 용해성은 들깨박에서 유의적으로 낮은 수치를 나타내었다(p<0.05). 가수분해도는 박류 사료 종류 및 단백질 가수분해효소에 따라 수치상으로 미미한 차이를 보였으나(p<0.05), 들깨박은 대두박과 옥수수 주정박에 비하여 다소 낮은 수치를 나타내었다(p<0.05). DPPH 라디칼 소거능은 Alcalase 처리한 들깨박 가수분해물 분획에서 유의적으로 높은 수치를 나타내었으며, ABTS 라디칼 소거능은 박류 사료를 트립신 처리한 가수분해물 분획에서 가장 높은 수치를 나타내었다. 환원력은 들깨박 가수분해물 분획이 대두박과 옥수수 주정박 가수분해물 분획보다 유의적으로 높은 수치를 나타내었다. 총 폴리페놀 함량은 들깨박 가수분해물 분획에서 유의적으로 높은 수치를 나타내었다(p<0.05). 따라서, 본 연구에서는 들깨박 가수분해물이 뛰어난 항산화 활성을 보여 대두박 가수분해물의 대체제로의 활용 가능성을 뒷받침할 기초자료가 될 수 있을 것으로 판단된다. 나아가 향후 연구에서는 박류 사료 단백질 유래 펩타이드를 분리 및 정제하여 얻어진 특정 펩타이드 분획의 직접적인 항산화 효과를 평가할 필요가 있다고 사료된다.
