Ⅰ. 서 론
면역이란 병원체 미생물과 같은 외부 인자에 관한 생물학적 방어 수단으로, 생체 내 항상성을 유지할 수 있도록 단핵구(monocyte), 호중구(neutrophile) 및 포식 세포(phagocyte)와 같은 다양한 면역세포의 상호작용을 통해 이루어진다(Shin, 2012). 이 중 대식세포는 체내로 침입한 항원을 탐식하고, 면역 조절 인자인 nitric oxide(NO), tumor necrosis factor-α(TNF-α), interleukin-6(IL-6) 및 interleukin-1β(IL-1β)등을 분비하여 선천 면역 세포군의 활성을 유도하는 것으로 알려져 있다(Beutler, 2004). 외부 인자에 의해 활성화된 대식세포는 선천 면역 활성을 유도하는 한편, T세포의 활성을 유도하고 항원 제시 세포(antigen presenting cell, APC)로서 적응면역계에서도 중요한 역할을 수행하는 것으로 보고된다(Birk et al., 2001). 최근엔 천연물을 이용한 인체 고유의 면역 방어체계 향상과 질병의 예방에 많은 관심과 연구가 집중되고 있으며(Chirumbolo, 2012), 이를 면역계의 반응을 유도하는 면역 조절제(immuno-modulator)로서 활용한 감염질환의 예방, 항암 면역치료법에 관한 연구가 꾸준히 진행되고 있다(Kaufmann et al., 2018).
식량부족, 환경오염 및 전쟁의 위협 등의 여파로 식량안보에 관한 관심과 식육 대체식품의 중요성이 강조되고 있다(Ramos-Elorduy, 2009). 식용 곤충은 대표적인 식육 대체식품으로, 빠른 증식을 통해 최소한의 사육 면적과 유지비용으로 대량 생산이 가능하다는 경제적 이점을 지닌다(Rumpold and Schlüter, 2013). 더불어 기존 축산업에 비해 온실가스의 배출량이 적으며, 양질의 단백질과 무기질 성분을 골고루 함유하고 있어 환경적, 영양적으로도 매우 우수한 대체식품으로 알려져 있다(Jantzen et al., 2020). 국내에서는 총 10종류의 식용 곤충이 식품의약품안전처의 식품공전(Ministry of Food and Drug Safety, 2022)에 등록되었으며, 그중 쌍별귀뚜라미(Gryllus bimaculatus)는 다른 식용 곤충에 비해 칼슘과 아연과 같은 미네랄을 다량 함유하며(Ghosh et al., 2017), 라이신, 류신, 발린과 같은 필수 아미노산이 풍부하여 기능성 발굴 연구도 활발히 진행되고 있다(Belluco et al., 2013). 현재 쌍별귀뚜라미는 항산화 활성(Cho et al., 2019), 면역 활성(Lim et al., 2022) 연구를 비롯한 다양한 기능성에 관한 연구가 진행되고 있으나, 아직 추출 온도에 따른 면역 활성에 관한 연구는 보고된 바 없다.
본 연구에서는 추출 온도를 달리한 쌍별귀뚜라미 물 추출물(Gryllus bimaculatus water extracts; GBWE)을 처리하여 대식세포의 NO, tumor necrosis factor-α(TNF-α), interleukin-6(IL-6) 및 interleukin- 1β(IL-1β) 분비 능과 세포 표면 활성 인자(cluster of differentiation; CD80/86, major histocompatibility cmplex; MHC clsssⅠ/Ⅱ)의 발현에 미치는 영향을 비교 분석하였다. 이를 통해 면역 증진 기능성 소재로써 활용에 있어 추출 온도의 영향을 관찰하고, mitogen-activated protein kinases(MAPKs) 인산화 및 nuclear factor kappa-light-chain-enhancer of activated B cells(NF-κB)의 발현을 관찰하여 GBWE의 대식세포 내 면역 작용 기전을 확인하였다.
Ⅱ. 재료 및 방법
본 연구에서 사용된 쌍별귀뚜라미는 ㈜후레쉬팜(Busan, Korea)에서 구매하여 사용하였다. 건조된 쌍별 귀뚜라미를 실험실용 분쇄기(NSG-1002SS, Hanil, Seoul, Korea)로 분말화하였다. 쌍별귀뚜라미 30 g에 증류수를 600 mL를 추출 온도 5°C, 25°C 및 75°C에서 500 rpm으로 교반(HI324N-2, Hanna, Korea)하여 추출하였다. 추출물을 거름종이(No. 4, Whatman, Kent, UK)로 여과 후 이를 2,250 × g에서 10분간 2회 원심 분리하여 상등액을 획득하였다. 이후 상등액을 회전 감압 농축기(N-1300E-W, EYELA, Singapore)를 이용해 농축한 후 동결 건조하여 –70°C에서 보관하여 본 실험에 사용하였다.
마우스 유래의 대식 세포주 RAW 264.7 cell은 한국 세포주은행(Seoul, Korea)에서 분양받아 사용하였다. 세포 배양을 위해 10% fetal bovine serum(FBS, Gibco, Carlsbad, CA, USA), 1% antibiotics(100 unit/mL penicillin and 100 unit/mL streptomycin)가 포함된 Dulbecco’s Modified Eagle’s Medium(DMEM) 배지(Welgene, Seoul, Korea)를 사용하였고, 이는 37°C, 5% CO2 incubator(Thermo, Waltham, MA, USA)에서 배양하였다.
GBWE가 RAW 264.7 cell 대식세포 세포 생존율에 미치는 영향을 알아보기 위해 MTT assay를 실시하였다. 96 well plate에 1 × 104 cell/well의 농도로 RAW 264.7 cell을 분주한 후, 37°C, 5% CO2 incubator에서 12시간 동안 배양하여 세포를 완전히 부착시켰다. 500 ng/mL 농도의 lipopolysaccaride(LPS)와 농도별(500, 1,000 μg/mL)로 5°C, 25°C 및 75°C 추출물 GBWE를 처리한 뒤 24시간 동안 배양하였다. 그 후, 5 mg/mL 농도의 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT, Sigma-Aldrich Co, MO, USA) 용액을 well 당 20 μL 첨가하여 2시간 동안 반응시키고, 배양 상등액을 제거하였다. MTT 시약의 첨가로 생성된 formazan을 녹이기 위해 dimethyl sulfoxide(DMSO, Sigma-Aldrich Co.)를 100 μL씩 첨가한 뒤 microplate reader기(Bio-Rad Inc, Hercules, CA, USA)를 이용하여 570 nm에서 흡광도를 측정하였다. 이때 control(medium only)의 흡광도 값을 기준으로 세포 생존율을 비교하였다.
앞서 사이토카인 분비 유도능 평가에서 사용한 상등액 500, 1,000 μg/mL를 사용하여 NO 분비량을 확인하였다. 상등액 100 μL에 동량의 Griess(Sigma-Aldrich Co.) 시약을 처리하고, 암실에서 10분 동안 반응시킨 후 microplate reader를 이용해 540 nm에서 흡광도를 측정하였다. 이때 NO의 농도는 sodium nitrite(NaNO2, Sigma-Aldrich Co.)를 통해 얻은 표준 곡선을 이용하여 계산하였다.
GBWE 처리가 cytokine 분비에 미치는 영향을 확인하기 위하여 enzyme linked immunosorbent assay(ELISA)로 확인하였다. 48 well plate에 RAW 264.7 cell을 5 × 104 cell/well이 되도록 분주한 후 37°C, 5% CO2 incubator에서 12시간 배양해 세포를 완전히 부착시켰다. 500 ng/mL 농도의 LPS와 농도별(500, 1,000 μg/mL)로 GBWE를 처리한 후 24시간 동안 배양하고 배양 상등액을 분리하였다. 분리된 배양 상등액을 사용하여 TNF-α, IL-6 및 IL-1β함량을 측정하였다. Cytokine의 함량은 ELISA kit(eBioscience Co, San Diego, USA)를 사용하여 측정하였으며, 흡광도는 450 nm에서 측정하였다. 이때 사이토카인의 농도는 kit에 포함되어 있던 TNF-α, IL-6 및 IL-1β의 표준 용액(2,000-0 pg/mL)으로부터 산출된 표준 곡선을 이용하여 계산하였다.
GBWE의 처리가 대식세포의 세포 표면 활성 인자의 발현에 미치는 영향을 측정하기 위하여 RAW 264.7 cell을 각 48 well plate에 5 × 104 cell/well 농도로 분주한 후, 37°C, 5% CO2 incubator에서 12시간 배양하여 완전히 부착시켰다. GBWE를 500, 1,000 μg/mL의 농도, LPS를 500 ng/mL 농도로 처리한 후 24시간 동안 반응시킨 후 세포를 회수하였다. 항체의 비 특이적인 결합을 방지하기 위하여 회수된 세포에 1 μg/mL의 Fcγ I/III(BD Biosciences, San Diego, USA)을 처리하여 4°C에서 20분간 반응시킨 후, 대식세포 표면 활성 인자 분석을 위하여 anti-CD 80-PE, anti-CD86-PE, anti-MHCⅠ 및 Ⅱ-PE(BD Biosciences)와 같은 세포 표면 항체를 1,000배씩 희석하여 각각의 세포에 처리하고 30분 동안 반응시키며, 이를 유세포 분석기(FACS callibur, BD Biosciences)를 이용하여 분석하였다.
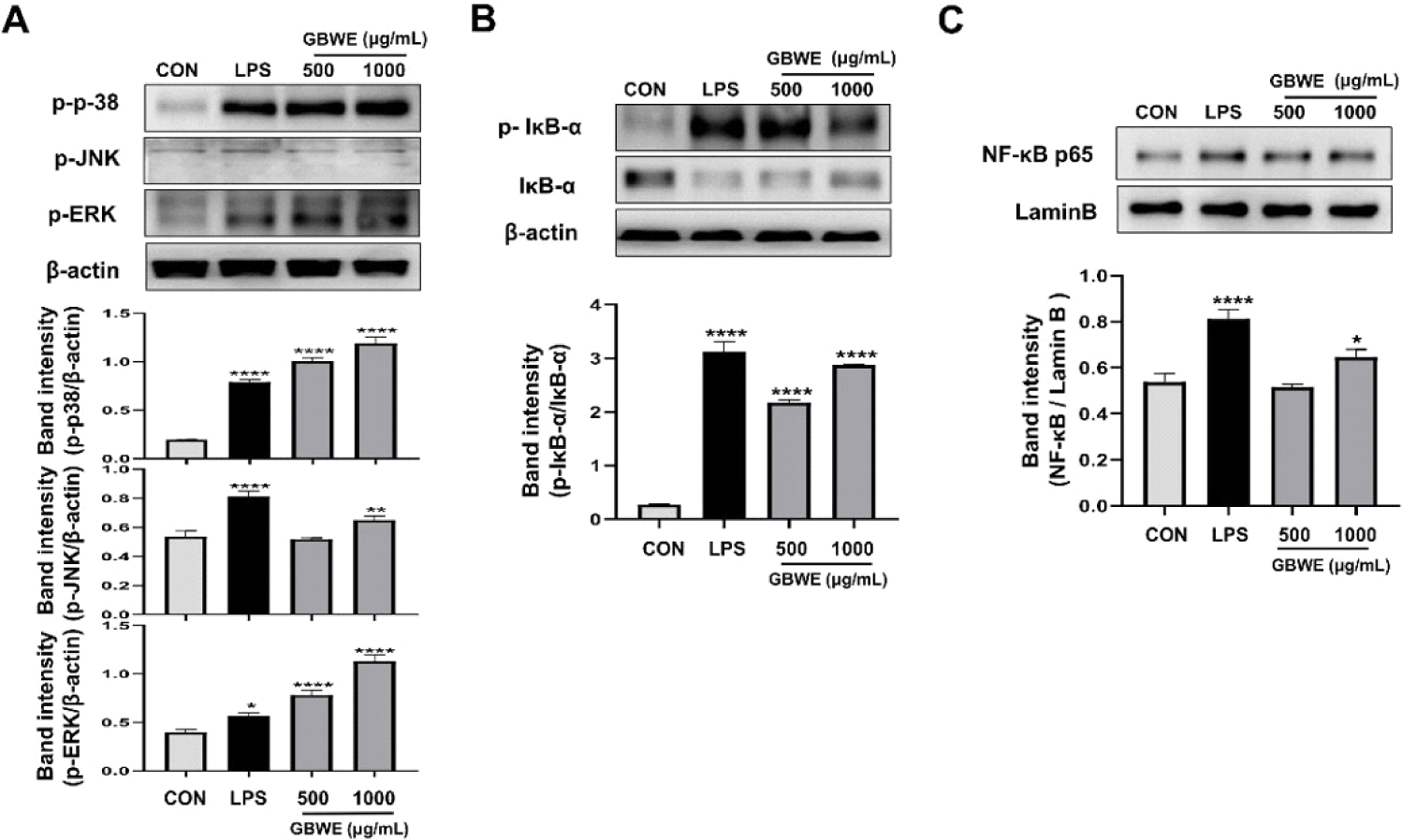
6 well plate에 2 × 105 cell/well의 농도로 RAW 264.7 cell을 분주하여 12시간 동안 완전히 부착시키고 LPS를 500 ng/mL의 농도로, GBWE를 500, 1,000 μg/mL의 농도로 처리하였다. 30분 동안 37°C, 5% CO2 incubator에 반응시킨 후 세포를 수집하여 PBS로 3회 세척하고 RIPA Buffer(Thermo Scientific, Rockford, IL, USA)를 첨가한 뒤 10,000 × g에서 30분간 원심분리해서 cell lysate를 분리하였다. 핵 내의 단백질을 분리하기 위하여 수집한 세포에 저장성 완충액[10 mM N-(2-hydroxyethyl) piperazine-N'-(2-ethanesulfonic acid)(HEPES), pH 7.9, 1.5 mM magnesium chloride(MgCl2), 10 mM potassium chloride(KCl), 0.5 mM dithiothreitol(DTT), 1 μM leupeptin과 0.2 mM phenyl methyl sulfonyl fluoride(PMSF)]을 20분간 처리한 후 12,000 × g에서 1분간 원심 분리하여 세포질과 핵을 분리하였다. 분리한 핵을 고장성 완충액[20 mM HEPES, pH 7.9, 25% glycerol, 420 mM ethylene diamine tetra acetic acid 0.5 mM DTT, 1 μM leupeptin, 0.2 mM PMSF]으로 처리하여 10,000 × g에서 20분간 원심분리하여 핵단백질을 추출하였다. BCA protein detection kit(Thermo Fisher Scientific Inc., Rockford, IL, USA)을 사용하여 단백질을 정량하고, well 당 20 μg의 cell lysate를 10% polyacrylamide gel에 각각 loading하여 SDS-PAGE로 변성 분리하였다. 이를 polyvinylidene difluoride membrane(Millipore, Merck KGaA, Darmstadt, Germany)으로 transfer하였고, membrane은 anti-body의 비특이적 결합을 방지하기 위해 blocking solution(5% skim milk) 20 mL로 1시간 동안 방치하였다. 이후 TBST(20 nM tris-HCl, 150 mM NaCl, 0.05% Tween-20, pH 7.5)로 10분씩 3회 세척한 뒤 p-p38, p-ERK, p-JNK 및 IκB-α, NF-κB의 발현량을 측정하기 위해 1차 항체(Cell Signaling Technology, Danvers, MN, USA)를 1:3,000으로 희석하여 2시간 동안 반응시키고, TBST로 5분간 3회 세척하였다. 이후 2차 항체(goat-anti rabbit lgG, Calbiochem, La Jolla, USA)를 1:3,000으로 희석하여 1시간 동안 반응시키고, TBST로 15분간 4회 세척하며, electrochemiluminescence(Millipore Merck KGaA)를 사용하여 인화하였다.
Ⅲ. 결과 및 고찰
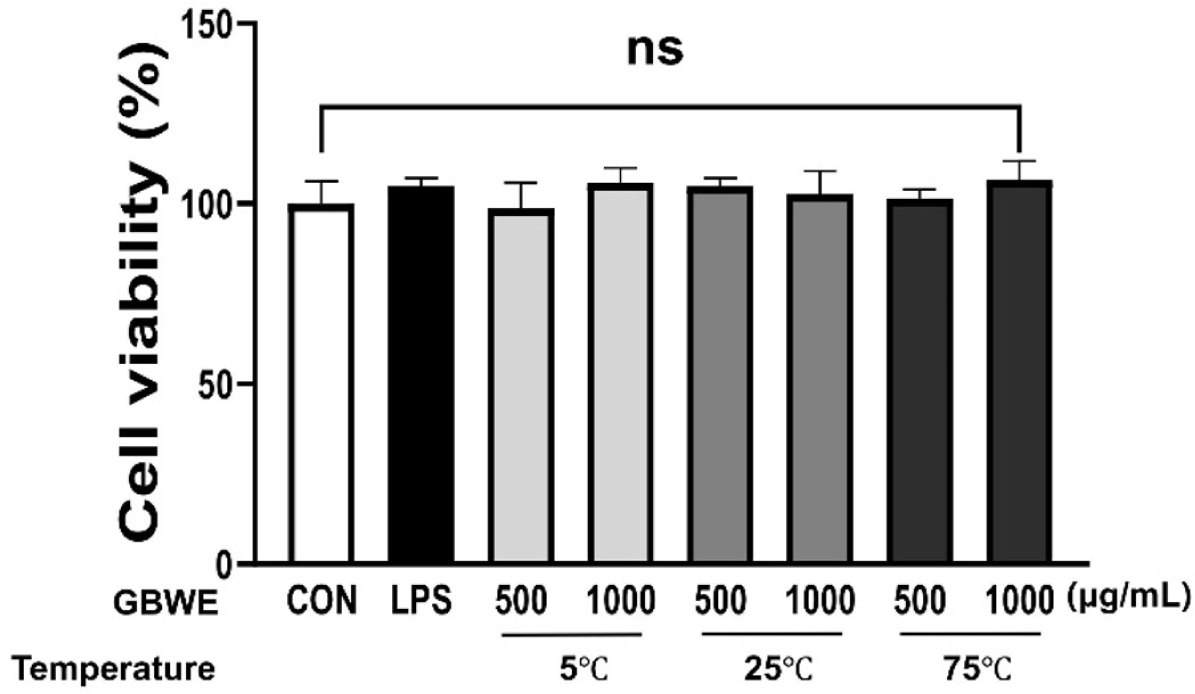
GBWE가 대식세포에서의 세포생존율에 미치는 영향을 알아보기 위하여, RAW 264.7 cell에서 세 가지 추출온도조건(5°C, 25°C 및 75°C)의 GBWE를 처리 후 24시간 이후의 세포 생존율을 MTT assay를 통해 확인하였다. GBWE는 500, 1,000 μg/mL 농도로 처리하고, positive control(PC)로는 대식세포를 활성화시키는 Lipopolysaccharide(LPS)를 500 ng/mL 농도로 처리하였다. 그 결과, 대조군을 포함한 모든 온도 조건의 추출물이 500, 1,000 μg/mL 농도에서 음성 대조군 negative control(NC) 기준으로 100%에 근접한 세포 생존율을 나타내어 세포 독성이 나타나지 않은 것을 관찰하였다(Fig. 1).
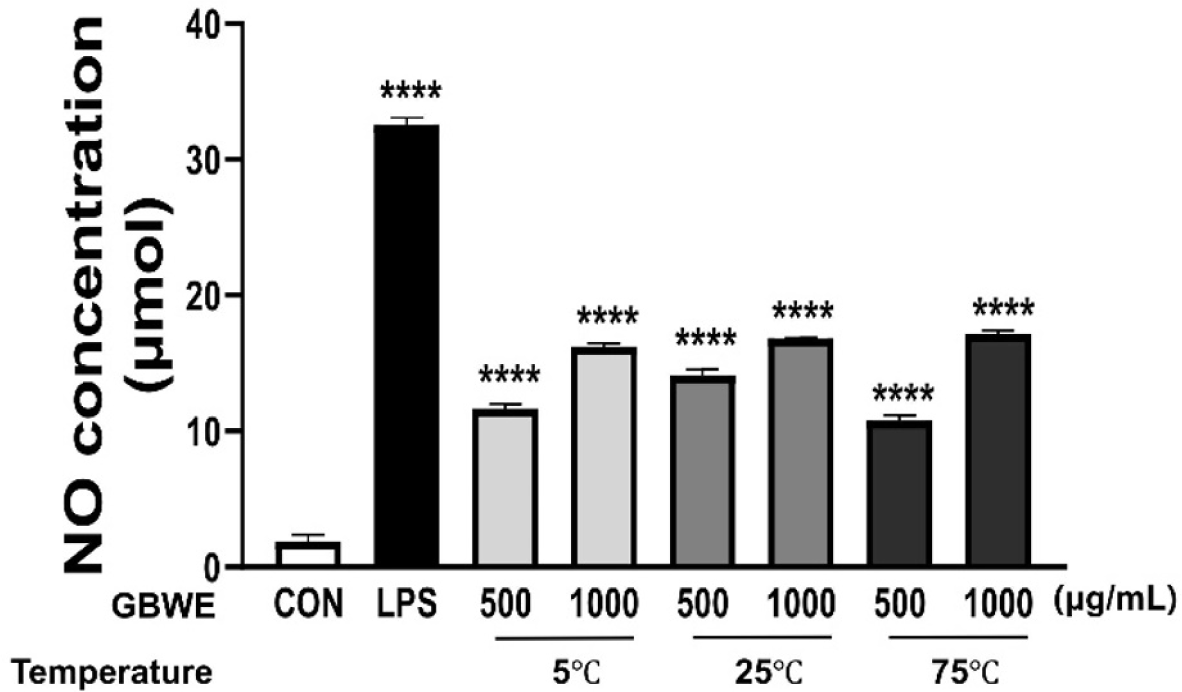
대식세포가 활성화되면 NO라는 강한 이원자 자유 라디칼을 분비하는데, 감염된 세포 및 암세포의 사멸을 조절하거나 세균과 바이러스로부터 신체를 보호하는 중요한 역할을 수행한다(Bogdan et al., 2015). GBWE가 대식세포의 면역반응을 유도하는지를 알아보기 위해 독성이 나타나지 않았던 500, 1,000 μg/mL 농도의 GBWE와 500 ng/mL 농도의 LPS를 RAW 264.7 cell에 처리한 후 NO 생성에 미치는 영향을 확인하였다. RAW 264.7 cell에 500, 1,000 μg/mL 농도로 처리된 세 가지 추출온도조건(5°C, 25°C 및 75°C)의 GBWE 처리 그룹은 NC대비 NO분비능이 효과적으로 유도되는 것을 관찰하였다(Fig. 2). 이러한 결과를 토대로, GBWE는 기존 연구에서 활발히 사용된 고온 (75°C)추출물뿐만 아니라, 저온(5°C) 및 상온(25°C)추출물에서도 NO 생성을 효과적으로 유도하여 대식세포의 면역반응을 증가시키는 것으로 사료된다. Kim 등(2020)에 따르면 쌍별귀뚜라미의 성분은 다른 식용 곤충에 비해 칼슘과 칼륨의 함량이 높으며, 아미노산 조성이 우수하고 BCAA(branched chain amino acids)를 다량 함유하여 생리활성에 효과적이라고 보고된다. 이러한 선행 연구들에 근거하여, 쌍별귀뚜라미에 풍부하게 함유되어 있는 단백질이 대식세포의 면역 활성을 유도하는 성분들 중 하나일 것으로 사료된다.
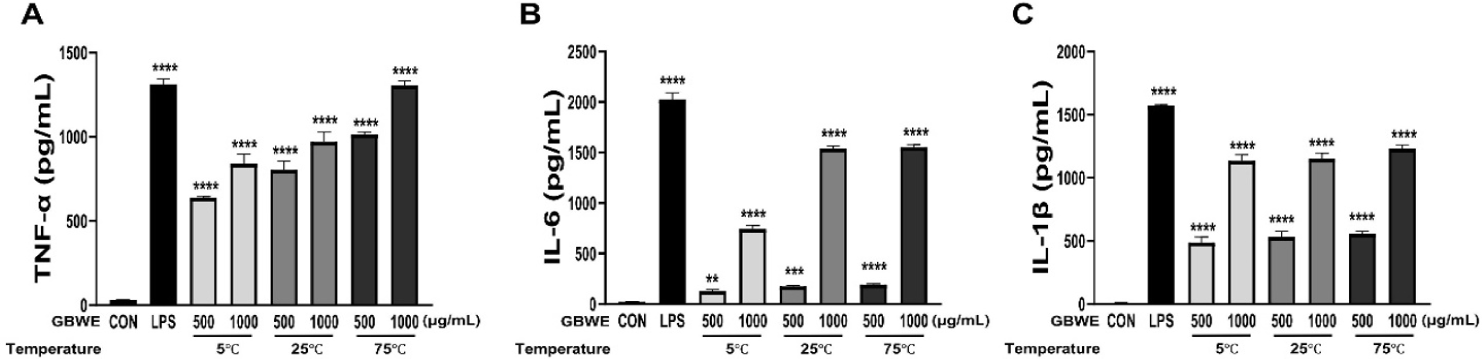
활성화된 대식세포가 분비하는 사이토카인은 면역체계의 신호 전달인자로서 특정 수용체를 통해 다른 면역세포들의 활성을 유도하고, 체액성 면역반응을 조절하는 것으로 알려져 있어 면역 활성을 나타내는 지표로서 사용된다(Wang and He, 2020). 대표적으로, TNF-α는 T세포의 활성화 및 증식을 유도하고, IL-6는 B세포를 활성화하여 항체의 생산을 유도하는 방식으로 면역 활성을 조절한다(Tanaka et al., 2014). IL-1β는 NK세포의 활성을 유도(Ambrosini et al., 2015)하는 것으로 알려져 있다. 이처럼 대식세포는 감염원에 의해서 활성화되어 비 특이적인 선천면역뿐만 아니라, 적응면역에도 관여하여 숙주의 방어체계에 있어 중추적인 역할을 수행한다(Hasselbalch, 2020). 따라서 추출 조건에 따른 GBWE에 의한 대식세포의 활성화를 관찰하기 위해 TNF-α, IL-6 및 IL-1β의 분비능을 측정하였다. 500, 1,000 μg/mL 농도의 GBWE와 LPS(500 ng/mL)를 처리한 결과, 모든 추출온도조건(5°C, 25°C 및 75°C)의 GBWE 처리 그룹의 사이토카인 분비가 NC대비 증가하는 것을 확인할 수 있었다(Fig. 3). Seo 등(2007)에 따르면 또 다른 귀뚜라미과(Family Gryllidae)에 속하는 왕귀뚜라미(Teleogryllus emma) 추출물이 마우스 유래 비장세포에서 IL-4, TNF-α의 분비를 유도하여 면역반응 증진 효과를 나타내는 것으로 확인되었으며, 이는 본 연구의 결과와 유사한 경향을 나타내었다. 따라서 고온(75°C)추출 조건의 GBWE와 마찬가지로, 저온(5°C) 및 상온(25°C)추출 조건의 GBWE 또한 대식세포의 활성화를 통해 사이토카인 분비를 효과적으로 유도한 것으로 사료된다.
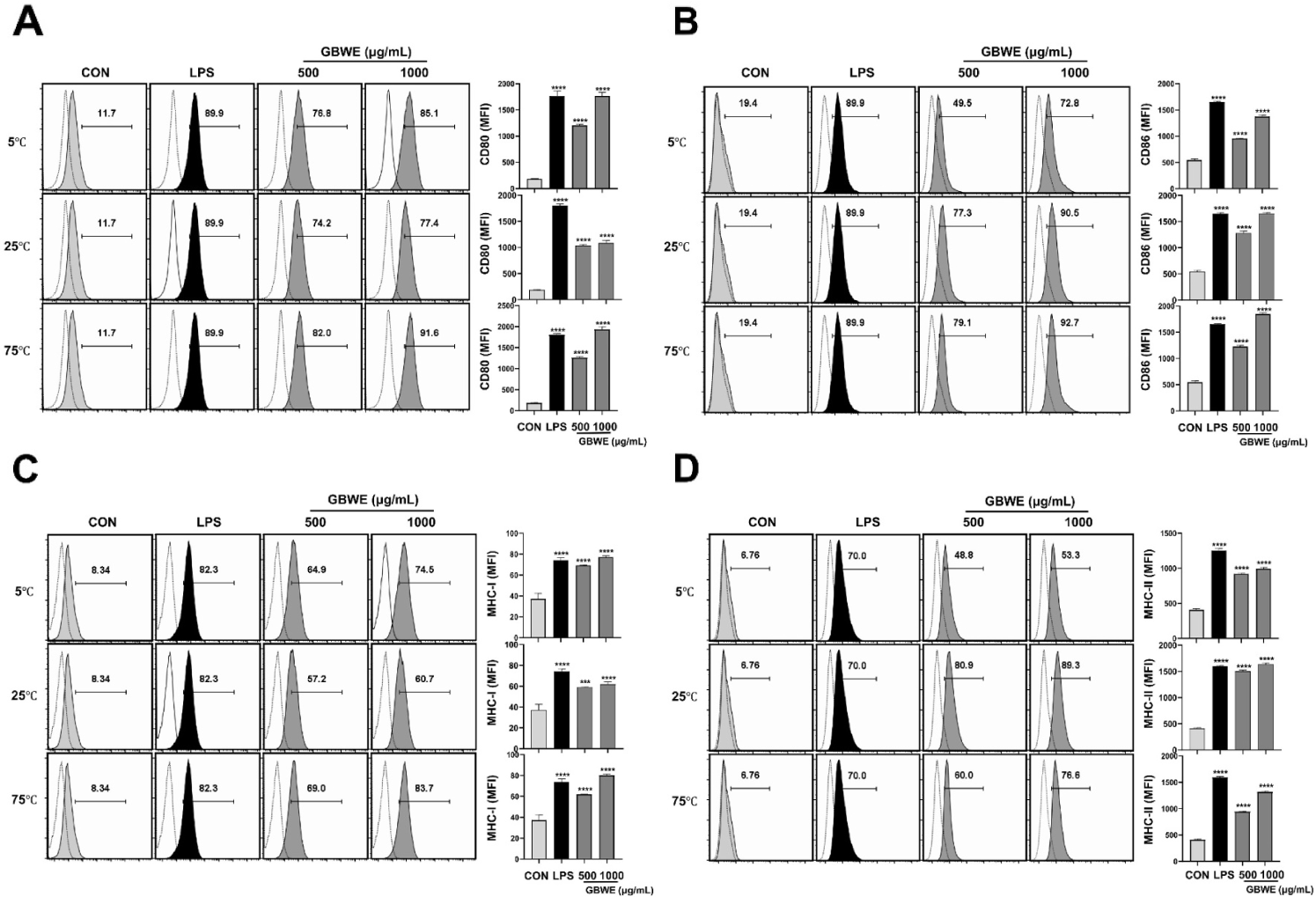
세포표면항원무리(cluster of differentiation, CD)는 면역표현형에 따라서 세포 표면 분자를 구분하고 연구하는데 유용하며, 면역반응에 대표적인 CD80 및 CD86의 발현은 T세포의 반응을 촉진하고, 항원 제시 세포 활성화에 꼭 필요한 요소라고 알려져 있다(Sansom et al., 2003). 한편, 주조직적합성 복합체(major histocompatibility complex, MHC) 분자는 면역계의 작용에 매우 중요한 역할을 한다. 병원체와 같은 항원을 탐식한 대식세포는 MHC에 항원을 결합한 복합체의 형태로 세포막에 나타냄으로써, T세포로 하여금 후천성 면역 반응을 유도한다(Guerriero, 2019). 각기 다른 추출온도조건(5°C, 25°C 및 75°C)의 GBWE 처리가 대식세포의 CD80, CD86 및 MHC class I/Ⅱ 발현에 미치는 영향을 확인하고자 500, 1,000 μg/mL 농도로 처리 후, 유세포 분석기를 통해 관찰하였다. CD80의 발현을 측정한 결과, 500, 1,000 μg/mL 농도의 GBWE 처리 그룹은 5°C 조건에서 각각 65.1%, 73.4%, 25°C 조건에서 62.5%, 65.7% 그리고 75°C 조건에서 70.3%, 79.9%만큼 NC대비 증가한 것을 관찰하였다(Fig. 4A). CD86의 발현의 경우, 500 , 1,000 μg/mL 농도의 GBWE 처리 그룹은 5°C 조건에서 각각 30.1%, 53.4%, 25°C 조건에서 57.9%, 71.1% 그리고 75°C 조건에서 60.3%, 73.3%만큼 NC대비 증가하는 것으로 나타났다(Fig. 4B). MHC class I의 발현을 측정한 결과, 500, 1,000 μg/mL 농도의 GBWE 처리 그룹은 5°C 조건에서 각각 56.6%, 66.2%, 25°C 조건에서 48.9%, 52.4% 그리고 75°C 조건에서 60.7%, 75.4%만큼 NC대비 증가한 것을 관찰하였다(Fig. 4C). MHC class Ⅱ의 발현은, 500 , 1,000 μg/mL 농도의 GBWE 처리 그룹은 5°C 조건에서 각각 42.0%, 46.5%, 25°C 조건에서 74.1%, 82.5% 그리고 75°C 조건에서 53.2%, 69.8%만큼 NC대비 증가하였다(Fig. 4D). 이러한 결과를 토대로 모든 추출온도조건(5°C, 25°C 및 75°C)의 GBWE가 대식세포의 CD80, CD86 및 MHC class I/Ⅱ의 발현을 유도하는 것을 확인하였다. 따라서 고온(75°C)추출조건의 GBWE와 마찬가지로, 저온(5°C) 및 상온(25°C)추출조건의 GBWE 또한 대식세포를 활성화 시키는 것으로 사료된다.
대식세포의 초기 면역반응에 있어, 세포 밖 조절 단백질 인산화 효소(extracellular regulated protein kinase; ERK), c-Jun NH2-단백질 인산화 효소(c-Jun amino-terminal kinases; JNK)와 세린/트레오닌 단백질 인산화 효소(serine/theronine protein kinase; p38)와 같은 단백질을 포함하는 MAPKs의 인산화는 사이토카인과 NO의 분비를 유도하여 대식세포를 활성화하는 중요한 신호전달 경로이다(Symons et al., 2006). 또한 NF-κB는 inhibitor of kappa B(IκB)와 결합되어 불활성화 상태로 세포질에 존재하다가 특정 자극에 의해 IκB의 인산화 과정을 거쳐 분리되어 핵 내부로 들어가 유전자 전사 인자로 작용하여, 면역기작을 나타내는 사이토카인과 NO의 분비에 영향을 끼치는 것으로 알려져 있다(Li와 Verma, 2022). 상기 실험에서 나타난 GBWE 처리에 의한 대식세포 활성화가 MAPKs 인산화 및 NF-κB의 핵 내 전사에 의한 것인지 알아보기 위하여, RAW 264.7 cell에 500, 1,000 μg/mL의 농도로 25°C의 GBWE와 LPS를 처리하고, MAPKs와 NF-κB의 인산화 정도를 관찰하였다. 그 결과, 500, 1,000 μg/mL로 처리된 GBWE와 LPS 처리 그룹 모두에서 NC대비 MAPKs(ERK, JNK, p38)의 인산화와, NF-κB의 핵 내 전사가 효과적으로 유도된 것을 확인하였다(Fig. 5). Kakazu 등(2009)의 연구에 의하면, 쌍별귀뚜라미가 풍부하게 함유하는 발린과 류신은 세포 증식에 필요한 단백질의 합성에 필수적이며, 골수성 수지상 세포(dendritic cell)에서 mTOR, NF-κB 신호전달에 영향을 준다는 결과가 보고되었으며, 이는 본 연구 결과와 유사한 경향을 나타내었다. 따라서 본 연구에서 GBWE의 처리에 의한 대식세포의 면역반응은 MAPKs 및 NF-κB 활성을 기반으로 이루어졌으며, 쌍별귀뚜라미 성분 가운데 단백질이 기여한 것으로 사료된다. 한편, 쌍별귀뚜라미 열처리 온도가 높을수록 필수 아미노산 및 단백질이 손실되어 상온에서 가장 높은 영양 성분이 관찰되었다는 Dobermann 등(2019)의 보고가 있었다. 더불어 Puertoals와 Barba(2016)에 따르면 식품 및 화학약품의 추출에 있어, 비 가열 처리방식 추출은 에너지 및 경제 비용을 줄일 수 있다고 보고된다. 이러한 선행 연구들에 근거하여, 상온(25°C) 추출 조건은 GBWE 제작과정의 단백질 성분 변성 및 파괴를 최소화할 뿐만 아니라, 경제적이며 에너지를 절약할 수 있는 유용한 추출 방법으로 활용될 것으로 사료된다. 그러나 추후 GBWE의 성분분석을 통해 면역 활성을 유도하는 구체적인 지표 성분을 파악하여 온도별 함량을 측정하고, 이를 분리 정제하여 면역 활성 효능을 검증하는 후속 연구가 필요할 것으로 사료된다.
Ⅳ. 요 약
본 연구에서는 추출온도조건(5°C, 25°C 및 75°C)별 쌍별귀뚜라미 물 추출물(GBWE)의 면역 활성 효과를 연구하기 위해서 대식 세포주 RAW 264.7 cell에 GBWE를 처리하여 사이토카인, NO 분비능, 세포 표면 발현 인자(MHC-I, MHC-II, CD80 및 CD86) 그리고 MAPK 신호전달경로 및 NF-κB 활성화 수준을 측정하였다. 세포독성을 나타내지 않는 농도에서 모든 추출온도 조건의 GBWE는 RAW 264.7 cell의 사이토카인(TNF-α, IL-6 그리고 IL-1β) 및 NO 생성을 유도하였고, 세포 표면 발현 인자(MHC-I, MHC-II, CD80 및 CD86)의 발현을 효과적으로 증가시켰다. 기전을 분석한 결과, GBWE 처리에 의한 대식세포의 면역 활성은 MAPKs의 인산화 및 NF-κB의 핵 내 전사를 통해 이루어지고 있음을 확인하였다. 종합적으로, GBWE의 처리는 MAPKs의 인산화와 NF-κB의 활성을 유도하고, 사이토카인 및 NO의 생성과 세포 표면 발현 인자의 발현을 증가시켜 RAW 264.7 cell의 면역 활성을 증진시키는 것으로 사료된다. 본 연구결과는 쌍별귀뚜라미가 고온(75°C)추출물을 포함하여, 저온(5°C) 및 상온(25°C)추출물에서도 면역 활성 증진효과를 가지고 기능성 소재로 활용될 수 있음을 제시한다.
