Ⅰ. 서 론
생활 수준이 점진적으로 향상됨에 따라 소비자들의 축산물의 품질에 대한 요구가 높아지고 있다. 가축의 종류 및 체조직의 종류와 부위에 따라 지방의 합성과 축적 등에 차이가 있다. 연구자들은 이들 지방의 생성과 축적을 조절하기 위해 식이를 이용한 영양적 방법, 천연 혹은 합성 첨가제를 이용한 물질의 개발 등 많은 노력을 경주하고 있다. Reversine은 1990년대 후반 Peter G. Schultz 연구팀에서 세포의 역분화 물질을 찾기 위해 합성한 물질 중의 하나이며, 화학적 구조는 2-(4-morpholinoanilino)- 6-cyclohexyaminopurine으로 되어 있다(Fig. 1A)(Chen et al., 2004). 연구자들은 세포의 교차분화를 유도하는 탁월한 합성 분자를 선발하는 과정 중에 reversine이 C2C12 세포주에 처리되었을 때 역분화 유도에 의한 다능성 전구세포(multipotent progenitor cell)의 형성과, 전구세포로 전환된 이들 세포에 뼈형성 배지 혹은 지방세포형성 배지에 배양하여 뼈와 지방세포로 각각 교차분화를 유도할 수 있음을 확인하였다(Chen et al., 2007; Chen et al., 2004). 세포에 대한 reversine의 기능은 근육세포주뿐만 아니라, 지방세포주와 섬유아세포 등에서 역분화와 다른 세포로의 교차분화도 확인되었다(Anastasia et al., 2006; Park et al., 2014). Chen 등(2004)에 의하면, reversine을 처리받은 C2C12세포는 myotube형성이 완전히 사라지고, 미분화된 형태의 세포 리프로그래밍 현상이 나타난다. 지방세포분화 유도 조건에서는 약 40%의 세포의 세포질에서 Oil-Red O(ORO) 염색으로 지방구의 형성을 확인하여 지방세포의 특성을 확인하였다. 이는 reversine의 처리를 받은 근육세포가 주변 생리적 환경이 지방형성에 유리한 환경으로 변할 경우, 지방을 합성하는 지방세포로 교차분화가 일어날 수 있음을 보여준다. 지방세포의 분화에서 reversine의 역할을 확인하기 위한 연구 결과를 보면, 지방세포의 분화가 진행되는 단계에서 reversine을 처리하게 되면 지방세포의 분화가 촉진된다고 하였다(Kim et al., 2007). 그러나 완전히 분화된 지방세포(fully differentiated adipocytes: 분화 유도 6일 후)에 reversine을 24시간 혹은 48시간 처리한 경우 adipocyte marker genes(adiponectin, adipsin, FASN: fatty acid synthase gene 등)의 발현이 감소한 보고도 있다(Kim et al., 2019). 이러한 결과들을 고려해 볼 때 reversine은 분화 단계별 처리 시기 혹은 처리 농도에 따라 지방세포분화에 다르게 작용할 가능성을 제기하게 되었다. 지방전구세포는 세포 발달 및 분화단계에 따라 cell proliferation, growth arrest, mitotic colonal expansion, post- mitotic growth arrest, terminal differentiation 등으로 뚜렷한 변화 과정을 보이기 때문에, 어느 단계에 특정 조절인자를 처리하는지에 따라 세포분화에 큰 영향을 미칠 것으로 사료되나, 아직까지 reversine 처리에 의한 지방세포의 분화 단계별 체계적 조절에 대한 보고는 없는 실정이다. 따라서, 본 연구는 3T3-L1세포에서 분화 단계별로 reversine을 처리하여 지방세포의 분화에 어떤 영향을 미치는지를 확인하고자 실시되었다.
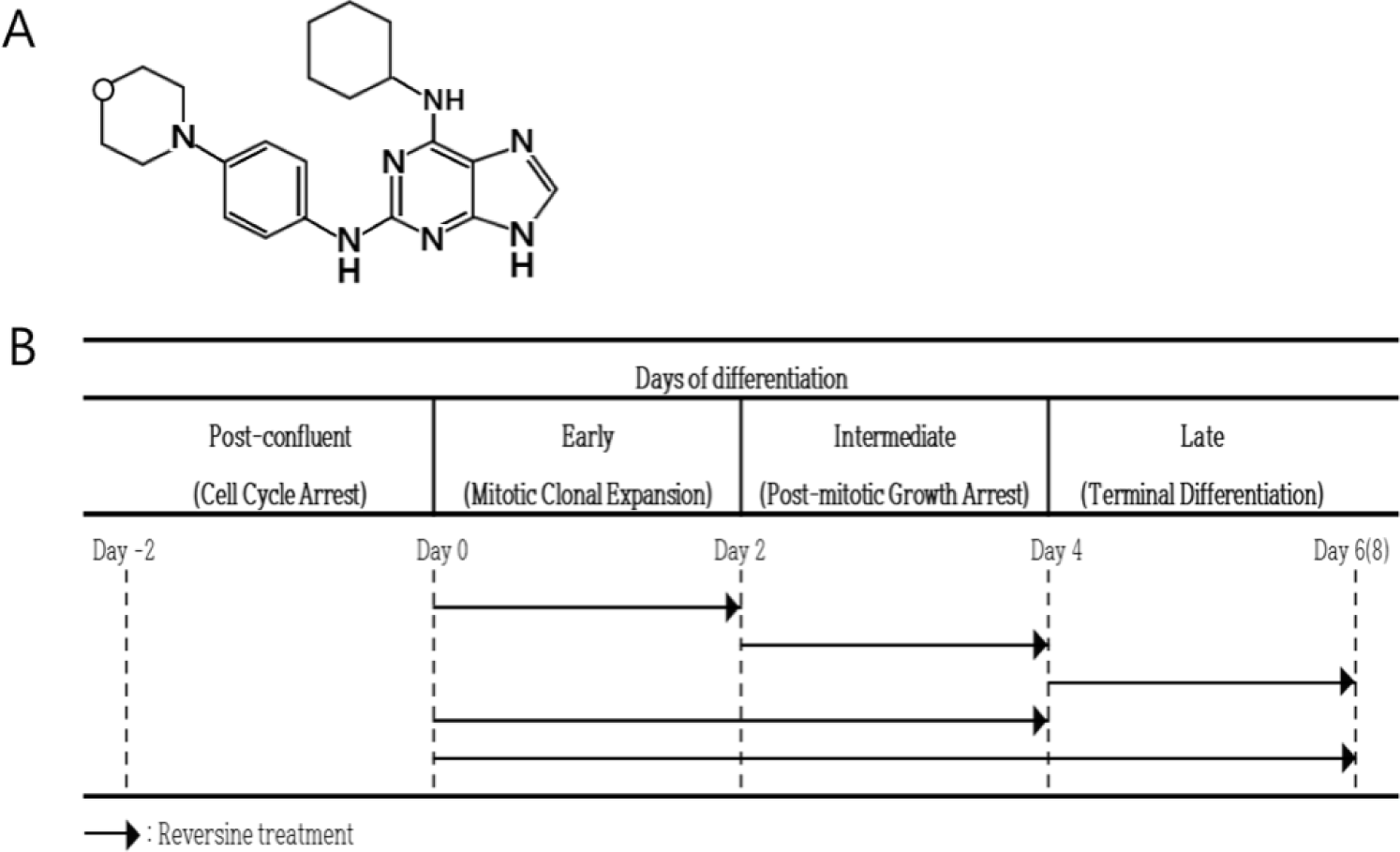
Ⅱ. 재료 및 방법
세포주 3T3-L1은 한국세포주은행 KCLB (Korean Cell Line Bank, Seoul, Korea)에서 분양 받아 사용하였다. 3T3-L1 지방전구세포는 Dulbecco’s Modified Eagle’s Medium (DMEM) (Gibco BRL, Grand Island, NY, USA)에 10% calf bovine serum(Gibco BRL)으로 배양하였다. 3T3-L1세포가 confluent된 다음 2일 후(day 0)에 10% fetal bovine serum (FBS: Gibco BRL)에 지방세포분화 유도배지 성분(insulin 167 nM, 3-isobutyl-1-methylxantihine 0.5 mM, dexamethasone 5 μM)이 함유된DMEM에서 세포의 분화를 2일간 유도하였다(day 0 - day 2). 세포는 10% FBS와 insulin이 첨가된 배지에서 2일간 추가 배양하였으며(day 2 - day 4), 이후 2일 간격으로 10% FBS-DMEM 배지를 교환하여 성숙된 지방분화세포를 유도하였다. 모든 배지에는 penicillin 100 U/mL와 streptomycin 100 μg/mL (Gibco BRL)이 포함되도록 하였다. 세포는 37℃로 유지되는 5% CO2 조건의 배양기에서 배양하였다. 지방세포의 분화 및 세포 내 지방구 형성을 확인하기 위하여 ORO(Sigma Co, St Louis, MO, USA) 염색을 실시하였으며, 세부적인 방법은 Kim 등(2011)이 기술한 방법으로 진행하였다. 염색된 세포는 광학현미경으로 관찰한 후, 세포 내 지방의 축적 정도를 측정하기 위하여 isopropanol을 이용하여 세포로부터 염색을 추출한 다음 분광광도계 490nm에서 흡광도를 측정하였다. Reversine (Sigma- Aldrich, St. Louis, MO, USA)의 처리 효과를 조사하기 위하여 reversine을 농도별, 3T3-L1 지방전구세포의 분화 단계별로 처리(Fig. 1B)를 한 다음, 지방세포 분화 유도 배지를 이용하여 분화 유도를 하고, 분화 유도 후 ORO 염색을 실시하였다.
3T3-L1세포로부터 total RNA의 추출은 Trizol(Invitrogen, Carlsbad, CA, USA)을 이용하여 제조사의 이용 안내에 따라 total RNA를 추출하였다. cDNA 합성은 1 μg의 추출된 total RNA를 Improm-II Reverse Transcription System(Promega, Madison, USA)를 이용하여 합성하였으며, 합성된 cDNA는qRT-PCR을 위하여 이용되었다. qRT-PCR은 MyiQ(Bio-Rad, Hercules, USA)을 이용하여 시행하였다. PCR 반응물은 cDNA(50 ng) 4.5 µL, primer(5 pmole)는 forward primer, reverse primer 각각 0.25 µL, qPCR Master Mix 5 µL를 넣어 총 10 µL가 되도록 혼합한 후, 95℃에서 5분간 최초 변성을 시킨 다음, 95℃ 10초간 변성, 60℃에서 30초간 접합, 72℃ 10초간 확장과정을 40회 반복하였다. 그리고 95℃까지 온도를 상승시켜 재접합 과정을 거친 후 65℃에서 1분간 재확장 과정을 실시하였다. 마지막으로 65℃에서 0.1℃씩 상승시켜 형광접합물질인 SYBR green이 떨어져 나오는 마지막 과정을 수행하였다. 유전자 발현의 상대적 발현은 internal control Nono 유전자의 발현과 비교하여 2—△△Ct 방법을 이용하여 분석하였다(Livak and Schmittgen, 2001). 본 연구에 이용된 primer 정보는 Table 1에 제시하였다.
Ⅲ. 결과 및 고찰
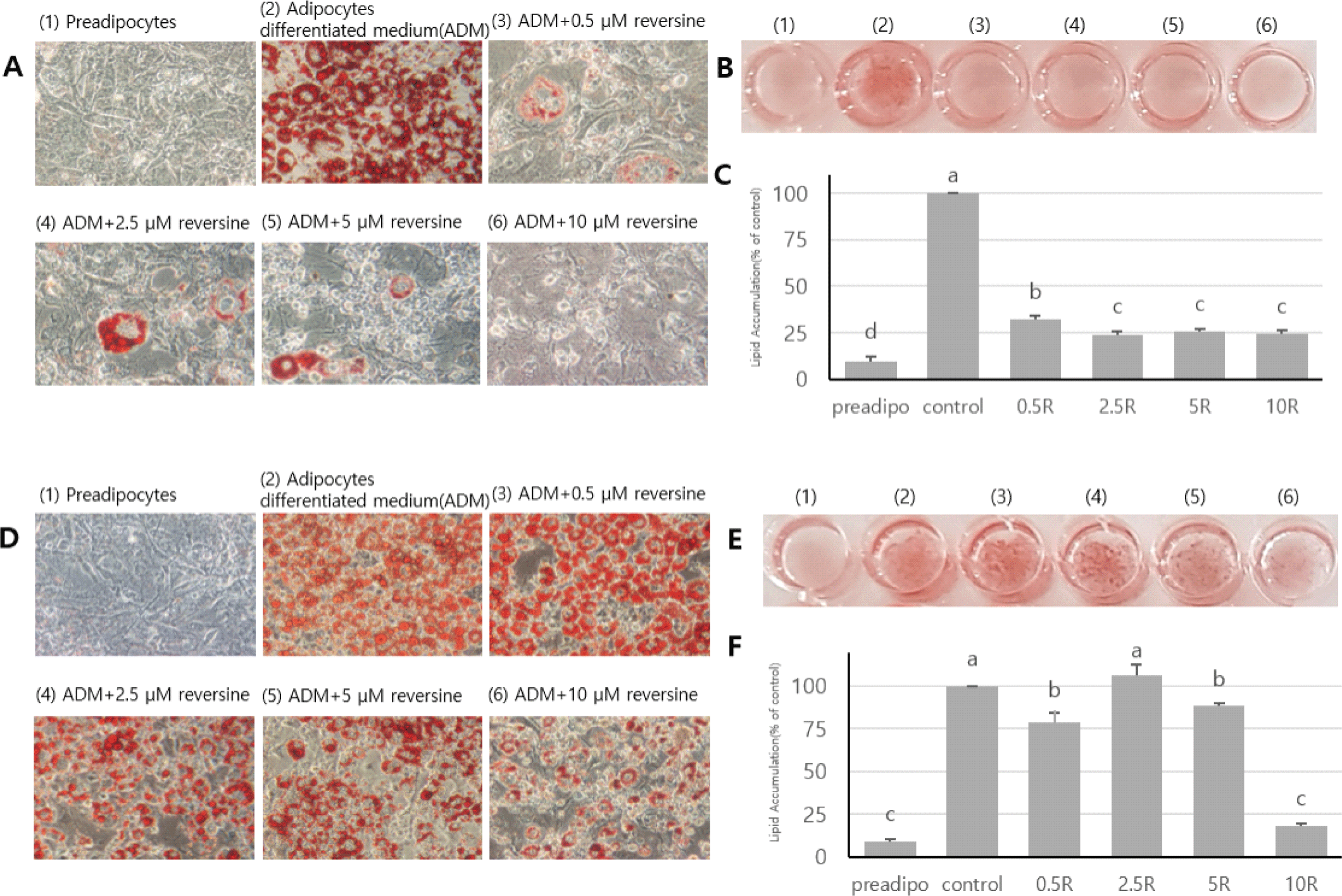
Reversine의 처리 농도가 지방세포분화에 어떤 영향을 미치는지를 확인하기 위하여 reversine의 농도(0, 0.5, 2.5, 5, 10 µM)를 달리하여 지방세포분화 초기부터 8일간 3T3-L1세포에 처리하였다. Reversine 처리에 의하여 지방세포분화는 현미경적 관찰(Fig. 2A)뿐만 아니라, ORO염색에 의한 세포 내 지방축적 분석 결과(Fig. 2C)에 의하면 reversine을 처리 받지 않고 정상적 분화가 일어난 세포들에 비하여 가장 낮은 농도(0.5 µM)에서 68%, 가장 높은 농도(10 µM)에서 76% 수준의 지방세포분화 감소를 보였다(p<0.05). 이는 Kim 등(2007)이 3T3-L1세포가 100% confluence된 2일 후 지방분화 유도배지와 동시에 reversine을 6일간 처리하였을 때, reversine을 처리 받은 3T3-L1세포가 지방세포분화 조건하에서 분화가 촉진되었다고 한 것과 차이가 있음을 보여준다. 따라서 reversine이 지방세포의 분화와 지방합성에 억제자로 작용하는지, 아니면 촉진자로 작용하는지 본 연구에서 확인할 필요성이 제기되었다. Reversine의 처리는 농도에 관계없이 대조구의 세포에 비하여 지방세포의 크기가 확대되었다. 이러한 결과는 섬유아세포, C2C12, 3T3-L1 등을 포함한 reversine을 처리 받은 세포들의 공통된 현상으로 세포의 형태가 크게 변하고, 배양용기에 납작하게 부착된 모양을 보이면서 세포의 증식은 완전히 억제되는 것과 유사하였다(Anastasia et al., 2006; Conforti et al., 2011; Park et al., 2014; Saraiya et al., 2010). 두 번째 시도는 지방세포가 분화된 이후 즉 성숙단계에 접어든 시점(day 4)부터 reversine을 위와 동일한 농도 별로 처리하였을 때 지방세포에 어떤 영향을 미치는지 조사하였다(Fig. 2D, Fig. 2E, Fig. 2F). 지방세포의 분화초기부터 reversine을 처리한 경우에 비하여 지방세포의 지방형성 억제는 크게 감소하지 않았지만, 높은 농도(10 µM)에서는 약 80%의 지방형성 억제 효과를 나타내었다(Fig. 2F). 세포가 Fig. 2에서 보여준 것처럼 reversine의 처리가 분화유도 초기부터 지속적으로 처리한 경우, reversine의 농도에 관계없이 지방세포의 분화가 억제된 것으로 판단되어 지방세포의 분화 단계별로 처리에 따른 차이가 있는지, 그리고 처리 기간에 따른 억제 효과를 확인할 필요성이 제기되었다. 따라서 다음은 reversine이 지방세포의 분화 단계에 따라 어떤 영향을 미치는지 확인하기 위하여 Fig. 2에서 보여준 결과를 바탕으로 reversine 농도(0, 0.5, 5 µM)와 처리 시기 및 기간을 달리하여 지방세포의 분화와 지방세포 특이적 관련 유전자들의 변화를 조사하였다.
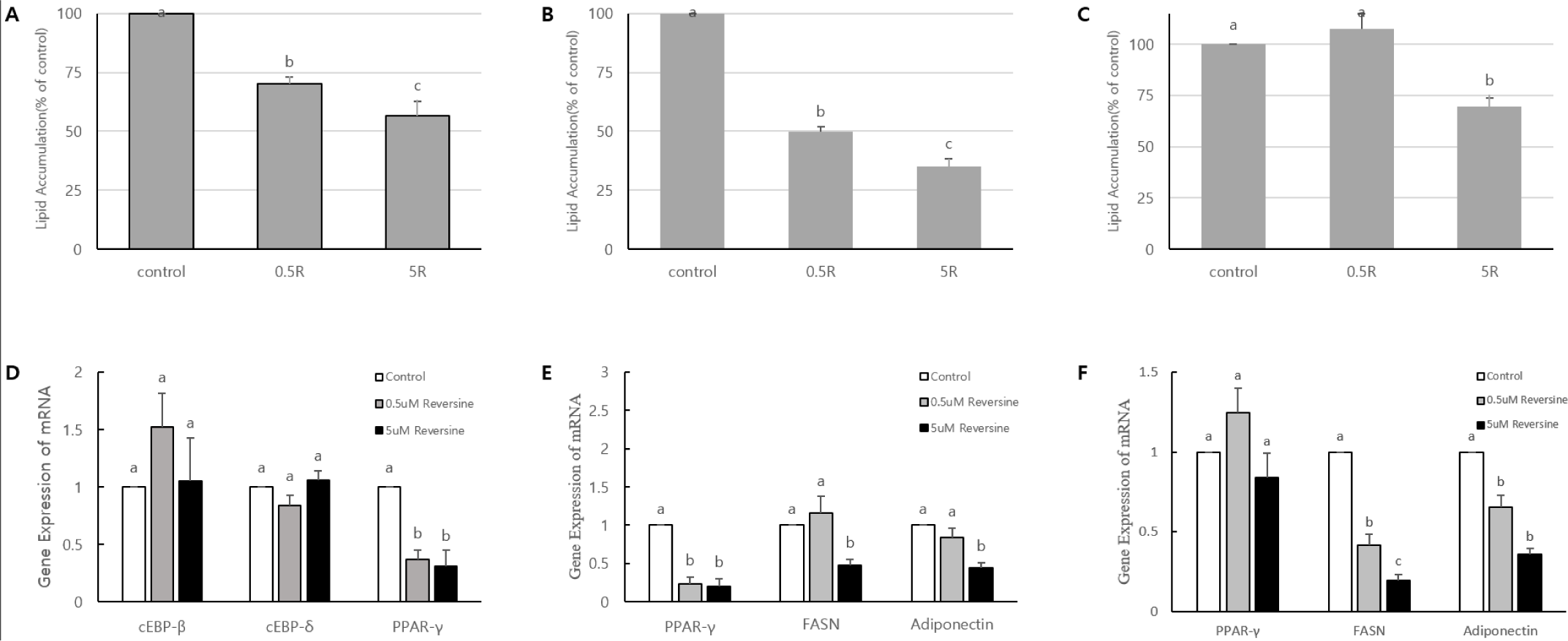
지방세포의 분화유도 초기 즉 클론확장 단계(mitotic clonal expansion: day 0-day 2), 분화유도 중간단계(post-mitotic growth arrest: day 2-day 4), 그리고 분화유도 말기단계(terminal differentiation: day 4-day 6)에 reversine(0, 0.5, 5 µM)을 2일간 처리한 후 분화 유도 6일차(day 6)에 ORO 염색을 실시하여 세포 내 지방축적을 분석하여 제시하였다(Fig. 3A, Fig. 3B, Fig. 3C). 그리고 각 분화단계에 reversine을 2일간 처리한 후 RNA를 추출하여 지방세포 분화초기에 관여하는 전사인자(transcription factor) 유전자들의 발현을 조사하여 Fig. 3D, Fig. 3E, Fig. 3F에 각각 제시하였다. Reversine 처리가 clonal expansion 기간에 이루어지면 지방세포의 분화가 형태학적으로 크게 억제되었고, 세포 내 지방구 형성 또한 reversine의 농도가 증가함에 따라 약 30%(0.5 µM)에서 43%(5 µM)까지 감소하였다(Fig. 3A)(p<0.05). 클론확장 단계에 reversine을 처리한 경우 전사인자인 CCAAT/enhancer-binding protein(C/EBP)β, C/EBPδ, 그리고 peroxisome proliferator-activated receptor (PPAR)γ 중에서 C/EBPβ와 C/EBPδ의 발현의 변화는 나타나지 않았으나, PPARγ는 대조구에 비하여 reversine의 처리 농도 와 관계 없이 0.5 µM에서 63%, 5 µM에서 69% 감소하였다(Fig. 3D)(p<0.05). 3T3-L1 지방전구세포는 배양용기에서 세포증식을 지속하다가 증식을 위한 공간이 제공되지 않으면 성장이 정지되고(growth arrest), 이후 지방세포분화를 유도하면 세포 주기(cell cycle)에 다시 들어가 3-4회 유사분열 클론 확장에 의한 세포수의 증가(clonal expansion)가 수반된다(Fève, 2005; Gregoire et al., 1998). 이 과정은 지방세포 분화에 필수적인 과정이며, 지방세포 성숙에 중요한 단계이다(Tang et al., 2003). Clonal expansion 단계에서 전사인자 C/EBPβ가 지방세포의 증식 및 분화에 중요한 전사인자 PPARγ와 C/EBPα의 발현을 유도하여 앞서 세포성장이 정지된 세포들을 일시적으로 분열하게 하여 세포수의 증가가 약 2일간 지속되게 한다(Brun et al., 1996; Saitoa et al., 2009; Zang et al., 2004). 이와 같이 이전 연구자들이 중요한 시점으로 제시된 단계에 reversine을 처리한 본 연구에서는 대조구와 처리구간에 C/EBPβ와 C/EBPδ의 발현의 차이를 보이지 않은 반면, PPARγ의 발현은 revesine에 대하여 뚜렷한 억제를 보이는 것으로 보아, reversine에 의한 지방세포분화 억제는 C/EBPβ와 C/EBPδ 보다 는 전사인자 PPARγ의 발현 감소가 중요한 역할을 하는 것으로 사료된다. 지방세포의 분화유도 초기 클론확장 직후, 즉 성장 중지 시점부터 최종분화 단계이전(post-mitotic cells: day2-day4)까지 2일간reversine을 처리 받은 세포에게 추가적으로 2일간 분화 유도하여 세포 내 지방축적을 분석하여 제시하였다(Fig. 3B). 세포 내 지방구 형성은 처리되는 reversine의 농도가 증가함에 따라 뚜렷하게 감소 (50%~65%)하였다(p<0.05). Reversine처리 2일 후(day 4)의 PPARγ의 발현은 대조구에 비하여reversine의 농도와 관계 없이 reversine 처리에 의하여 약 76%-80%까지 감소하였다(p<0.05)(Fig. 3E). FASN유전자 발현은 저 농도에서 발현의 차이가 나타나지 않았으며, 고 농도에서 약 52% 감소함을 보였다(p<0.05). 그리고 adiponectin 유전자 발현은 FAS와 유사하게 저 농도에서는 대조구와 차이가 없었으나, 고농도에서 약 55%의 mRNA 발현의 감소를 보였다(p<0.05). 일반적으로 지방세포는 정상적 발달과 유지를 위해 세포의 분열, 세포분열의 중지(mitotic growth arrest), 그리고 분화와 같이 정교하게 조절된다. 최근 연구들에 의하면 일반적인 post-mitotic cell은 세포노화(cellular senescence)에 접어들게 되어 되돌릴 수 없는 세포주기 중단 상태에 이르러 다시는 분열할 수 없는 단계에 접어들게 된다(Childs et al., 2017; Sapieha and Mallette, 2018). 지방전구세포는 세포분열에 의한 세포 수 증가를 지속하다 첫 번째 가역적 성장정지(reversible growth arrest)를 거친 후 이후 지방세포분화를 유도하게 되면 클론확장을 위한 세포분열 후 2번째 불가역적 성장정지(irreversible growth arrest: post-mitotic growth arrest) 단계를 거친다(Tao and Umek, 2000). 지방세포도 이 post-mitotic growth arrest 단계부터 성숙한 세포로 볼 수 있다(Berry and Rodeheffer, 2013). Post-mitotic growth arrest 단계에 전사인자인 PPARγ(Tontonoz et al., 1994)와 C/EBPα(Lin and Fane, 1992)등이 세포의 분화촉진과 세포분열 중지를 유도하는 데 관여한다. 본 연구에서 post-mitotic growth arrest 후 2일간 reversine의 처리를 받은 지방세포에서 PPARγ의 유전자 발현 감소는 정상적으로 세포분화의 진행을 억제하고, 이 전사인자에 의해 조절 받는 FASN과 adiponectin까지 영향을 받아, 최종적으로 세포 내 지방구형을 감소시킨 것으로 사료된다. 지방세포의 분화단계에서 최종분화단계 혹은 말기분화단계에 접어드는 시기부터 2일간(day 4-day 6) reversine을 처리한 후 세포 내 지방형성과 지표 유전자 발현에 대한 결과는 Fig. 3C와 Fig. 3F에 제시한 바와 같다. 최종분화 단계의 지방세포는 reversine처리에 의하여 낮은 농도에서는 지방합성에 미치는 영향이 거의 없었으나, 높은 농도에 노출된 세포에서는 약 30%의 지방구 형성 억제 효과를 보였다(p<0.05). PPARγ의 발현은 reversine처리 농도에 영향을 받지 않았지만, 지방합성효소 유전자 FASN의 발현은 농도 의존적 감소를 보였으며, adiponcetin의 발현은 대조구에 비하여 발현이 억제되는 것을 알 수 있었다(p<0.05). 최종 분화단계인 성숙세포 과정은 분화된 지방세포가 형태적으로 둥글게 되고, 지방세포의 표현형을 결정짓는 유전자들의 발현이 활성화된다(Fève, 2005; Gregoire et al., 1998). 지방세포의 최종분화단계 동안 세포 내 지방합성(de novo lipogenesis)은 급격하게 증가한다. 이에 따라 중성지방(triacylglycerol)대사와 연관된 효소들을 위한 유전자들(ATP citrate lyase, malic enzyme, acetyl CoA carboxylase, fatty acid synthase 등)의mRNA의 발현 수준 또한 급격하게 증가한다(Paulauskis and Sul, 1988). 이들 유전자들 외에 성숙한 지방세포에서 분비되는 물질이면서 지방대사와 직접적으로 연관되는 adipsin, adiponectin, monobutyrin 등의 mRNA의 발현 또한 크게 증가한다(Dobson et al., 1990; Hu et al., 1996). PPARγ는 앞의 유전자들의 활성에 단독 혹은 다른 전사인자(C/EBPα)와 협력적으로 조절에 참여한다(Gregoire et al., 1998). 본 연구에서는 분화유도초기 reversine에 의해 가장 영향을 많이 받는 PPARγ를 중심으로 분화 단계별로 분석하였는데, PPARγ는 분화말기에 reversine에 의한 억제는 일어나지 않았음에도 불구하고, FASN와 adiponectin의 발현은 농도 의존적으로 감소하였다. 이는 reversine이 PPARγ와 관계없이 다른 인자의 억제를 통하거나 혹은 직접적으로 지방합성억제에 관여하여 지방합성억제에 영향을 미치는 것으로 사료된다. 본 연구의 결과는 완전히 분화된 시점(day 6)부터 48시간 동안 5 μM reversine을 3T3-L1 지방세포에 처리하여 adiponectin과 FASN의 발현이 억제된 보고(Kim et al., 2019)와 매우 유사하다. 그리고 Kim 등(2019)은 낮은 reversine 농도(2.5 μM)에서 leptin, adipsin, adiponectin 등의 mRNA 발현이 증가한 결과를 보고하였는데, 본 연구에서 낮은 농도(0.5 μM)로 적용한 유사한 조건에서 세포 내 지방구 형성 제한이 없어지는 경우와 PPARγ등의 발현이 reversine에 의해 억제되지 않는 현상을 발견하였다(Fig. 3C, Fig. 3F). 이와 유사한 보고는 낮은 농도 0.05 혹은 0.5 μM의 reversine을 C2C12의 역 분화를 위해 처리한 경우에도 지방세포 지표유전자들(adipocyte fatty acid-binding protein: aP2, lipoprotein lipase: LPL)의 증가가 관찰되었다고 한다(Amabile et al., 2009; D’Alise et al., 2008). 진핵 세포의 유사분열에 관여하는 Aurora kinase를 reversine이 낮은 농도에서 이의 억제자로서 작용하고, C2C12 myoblast는 지방세포로 역 분화되는 과정에 위의 지방세포 지표 유전자들이 증가한 것으로 설명하고 있다. 이러한 낮은 reversine 농도, 즉 특정 농도에서 근육세포나 지방세포에서 다른 세포적 반응을 보이는 결과에 대해서는 좀 더 연구가 필요한 것으로 보인다. 또한 고지방사료에 의해 유도된 비만 쥐에게 24일간 reversine을 정맥 주입을 한 경우, 체중 및 체지방 감소와 더불어 유사 갈색지방세포(beige cell)의 전환이 유도되고, 이로 인한 체내 열 발생 증가에 의한 체중 감소 유도 효과(Kim et al., 2019) 등을 고려해 볼 때 reversine은 in vitro에서 지방합성 억제뿐만 아니라, in vivo에서도 지방합성 억제 혹은 beige세포로의 교차분화에 의한 에너지 소비증가에 기여하는 물질임을 보여준다. 현대 육계의 장기간 집중적 유전자 선택에 의한 선발과 육종은 높은 성장률과 더불어 과도한 지방축적 특히 복부지방이 생산자뿐만 아니라, 소비자들에게 부정적 영향을 주었다. 본 실험 결과와 C2C12에 대한 연구자들의 내용을 종합해 보면, 육계에 reversine을 적용할 경우, 근육 내 지방형성을 유도하여 풍미를 높이고, 복부지방은 감소할 수 있는 잠재적 지방합성 조절 인자로 고려할 수 있다.
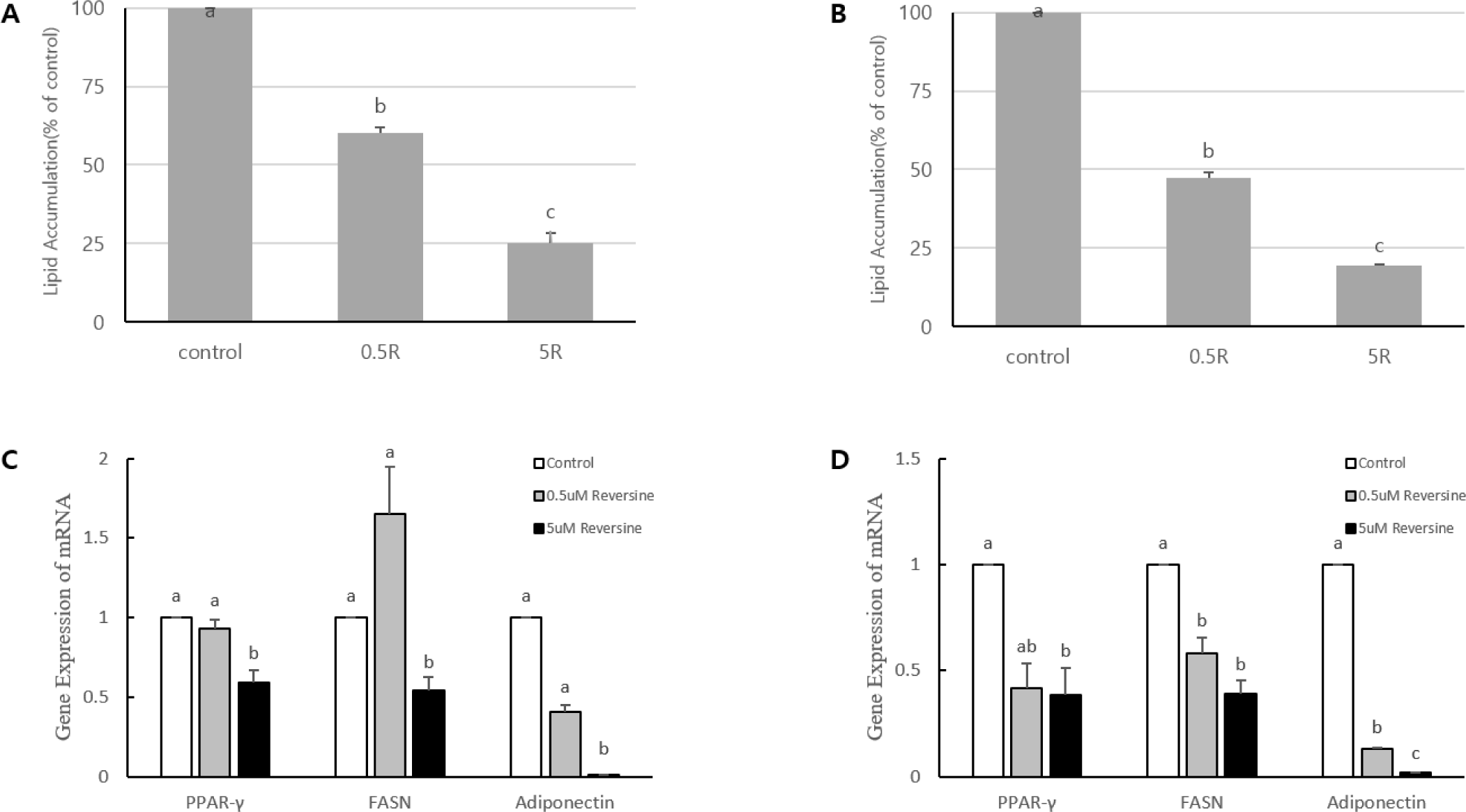
지방세포의 분화유도 초기부터 말기분화 단계 이전(day 0 - day 4), 혹은 말기분화기를 포함하는 기간(day 0 - day 6)까지 reversine을 처리하고, 분화 유도 6일 후(day 6)에 ORO 염색을 실시하여 세포내 지방축적과 관련 지표유전자들의 발현을 분석하여 제시하였다(Fig. 4A –Fig. 4D). Reversine을 분화유도 초기부터 4일간 처리 받은 지방세포는 세포 내 지방구 형성(Fig. 4A)이 농도 의존적으로 감소(40%~75%)하였다(p<0.05). PPARγ의 발현은 reversine의 저 농도에서는 대조구와 차이가 없었으나, 고 농도에서는 약 61%까지 감소하였다(p<0.05). FASN과 adiponectin 유전자 발현 또한 저 농도에서 대조구와 차이를 보이지 않았지만 고 농도에서 46%(FASN)와 99% (adiponectin)의 mRNA발현의 감소를 각각 보였다(p<0.05). 분화초기부터 가장 긴 구간(day 0 - day 6)의 reversine을 처리 받은 지방세포는 지방구의 형성이 reversine의 농도가 증가함에 따라 뚜렷하게 감소(53%~81%)하였다(p<0.05). PPARγ의 발현은 대조구에 비하여 reversine의 저 농도에서 약 58%, 고 농도에서 약 61%까지 감소하였다(p<0.05). FASN유전자 발현은 저 농도에서 42%, 고 농도에서 61%(FASN), 그리고 adiponectin의 유전자 발현은 FASN보다 더 뚜렷하게 mRNA발현의 감소(87~98%)를 보였다(p<0.05). Kim 등(2007)의 보고에 의하면 분화유도기간(day 0-day 6)에 지방분화 유도배지와 reversine을 처리한 경우 지방세포의 분화가 5.2배 증가하였으며, reversine과 troglitazone을 같이 처리한 경우는 12.6배 세포 내 지방구 형성이 증가하였다고 한다. 이 보고서에서 유도배지가 없는 상태에서 reversine 단독은 지방세포의 분화를 유도하지 못한 점을 강조하였다. 또한 adipogenic marker gene들인 PPARγ, resistin, aP2, adiponectin 등의 mRNA발현은 모두 증가하였으며, FASN과 SREBP1c의 발현은 거의 변화가 없었다. 그러나, 본 연구실의 사전 실험에서 Kim 등(2007)과 유사한 실험 조건에서 지방세포유도 배지와reversine을 3T3-L1에 처리한 결과, 지방세포의 분화 억제를 관찰하였고, PPARγ의 agonist인troglitazone을 reversine과 같이 처리하여 지방세포분화를 유도한 결과, reversine에 의한 지방세포분화의 억제 효과가 약 50% 회복되었다(unpublished data-YSMoon). 그리고 Fig. 4에서 제시한 것처럼reversine의 지방세포분화 유도와 동시에 지속적으로 처리할 경우, 지방세포 내 지방구형성과 관련 지방세포 표지 유전자들의 발현 감소를 보임으로서 이전에 보고된 Kim 등(2007)의 결과와 차이가 있었다. Reversine의 처리 시기에 차이는 있지만, 지방세포분화가 말기단계에 reversine을 처리한 Kim 등(2019)의 지방세포분화 억제 효과 및 지방세포 지표 유전자들의 발현 감소 보고와 본 연구결과가 매우 유사함을 보였다. Kim 등(2019)에 의하면 3T3-L1세포에서 최종분화를 유도한 후에 24시간 혹은 48시간 reversine을 처리한 경우, 지방합성효소 FASN과 adiponectin의 mRNA발현이 농도(0, 2.5, 5, 10, 15 µM) 의존적으로 억제되었다고 한다. 이러한 보고와 본 연구결과를 종합해 보면 지방세포의 분화초기부터 reversine을 처리를 한 경우에 지방세포의 분화를 억제하지만, 최종 분화가 된 지방세포에 reversine이 처리되어도 지방합성의 억제를 효과적으로 조절할 수 있음을 알 수 있다. Reversine에 의한 지방세포분화 억제 효과는 부분적으로 세포의 분화에 중요한 역할을 하는 PPARγ의 발현을 억제함으로서 이 전사인자의 조절을 받는 지방세포 특이적 유전자들 중 하나인 FASN과 adiponectin의 발현도 감소시키는 것으로 볼 수 있다. 그러나 지방세포가 분화가 완성된 이후에도 reversine의 처리에 의한 관련 유전자들의 발현 억제와 합성된 지방구가 감소하는 것으로 보아 reversine에 의한 지방세포분화 억제는 clonal expansion 단계의 전사인자 발현이 필수적인 것으로 보이지는 않는다. 본 연구의 day 0 - day 2에서 C/EBPβ와 C/EBPδ의 발현이 reversine에 의해 영향을 받지 않는 것 또한 이러한 결론을 뒷받침해준다. Reversine에 의한 지방세포분화 억제 효과는 처리되는 시점도 중요하지만 처리되는 농도와 처리되는 기간이 더 중요함을 볼 수 있다.
본 연구의 결과를 종합하면, reversine의 농도 및 기간에 따라 지방세포의 분화가 억제되는 것을 확인할 수 있었으며, 지방세포의 분화단계에 따른 reversine의 처리 시점 또한 지방세포의 분화 억제에 영향을 주고 있음을 보여주었다. 따라서, 본 연구는 reversine이 지방세포분화 조절자로서 그 가능성을 보여주었다고 사료된다.
Ⅳ. 요 약
본 연구에서는 3T3-L1 지방전구세포의 분화단계, 즉 클론확장 단계(day 0 –day 2), 세포성장정지 단계(day 2- day 4), 최종분화 단계(day 4- day 6)등에 따라 reversine의 농도와 처리 시기를 달리하여 지방세포 분화에 어떤 영향을 미치는지를 조사하였다. 본 연구 결과에 의하면, 지방세포의 분화는 reversine의 농도 의존적, 그리고 길게 처리할수록 지방세포의 분화를 더 억제하였다. 분화단계별 reversine 처리에 있어서는 클론확장 직후, 즉 성장 중지 시점부터 최종분화 단계 이전(post-mitotic growth arrest)에서 세포 내 지방형성 억제와 지방합성 지표유전자들(PPARγ, FASN, adiponectin)의 발현이 가장 크게 감소하였다. Reversine을 분화초기부터 분화말단 단계 이전 혹은 이후까지 지속적으로 처리한 경우, 처리기간과 농도가 높을수록 지방세포 내 지방구 형성뿐만 아니라, 관련 유전자들의 발현 또한 효과적으로 억제되었다. 따라서 본 연구의 결과는 지방세포의 분화에서 revesine이 전반적으로 분화 억제 작용을 하지만, 지방세포분화 중간단계(post-mitotic growth arrest)에서 지방세포 분화 억제자로서 가장 효과적으로 기능하고 있음을 보여주었다. 생활 수준이 점진적으로 향상됨에 따라 소비자들의 축산물의 품질에 대한 요구가 높아지고 있는 시점에서, 지방세포의 발달과 지방합성의 조절 물질 탐구는 축산물의 품질 향상과 생산비 절감 그리고 소비자의 건강에 큰 도움이 될 것으로 판단된다.
